-
室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
下列变化过程,属于放热反应的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧 ⑥食物腐败
A.②⑤⑥ B.②③④ C.①③⑤ D.②③④⑤⑥
难度: 简单查看答案及解析
-
在做中和热实验测定中和热时,应使用的仪器正确的组合是
①天平 ②量筒 ③烧杯 ④容量瓶 ⑤温度计 ⑥试管 ⑦酒精灯
A.①②④⑤ B.②③⑤ C.②③④⑦ D.全部
难度: 简单查看答案及解析
-
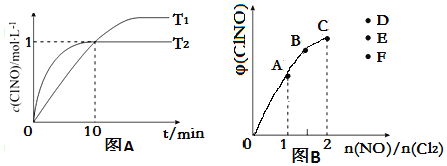
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1059.3kJ·mol-1
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-2153.4kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1076.7kJ·mol-1
难度: 简单查看答案及解析
-
已知H-H键键能为436kJ/mol,H-N键键能为391kJ/mol,根据化学方程式:N2+3H2
2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
A.431kJ/mol B.945.6kJ/mol C.649kJ/mol D.869kJ/mol
难度: 简单查看答案及解析
-
对于反应2A(g)+B(g)
2C(g)(正反应放热),下列图象正确的是( )
A.
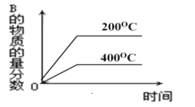
B.
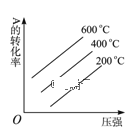
C.

D.
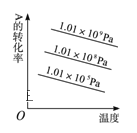
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述正确的是 ( )
A.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、
、
B.1.0mol/L的CH3COOH溶液:K+、Fe3+、
、Cl-
C.在c(OH-):c(H+)=1×1012的溶液:
、Ca2+、Cl-、K+
D.滴入酚酞试剂不变色的溶液:Na+、
、
、
难度: 简单查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)。在500℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25% B.50% C.75% D.80%
难度: 简单查看答案及解析
-
在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙>甲
C.H2的转化率:乙>甲 D.平衡混合气中H2的体积分数:乙>甲
难度: 中等查看答案及解析
-
a1、a2分别为A在甲、乙两个恒温容器中建立平衡体系A(g)
2B(g)时的转化率,已知甲容器保持压强不变,乙容器保持容器体积不变。在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
A.a1、a2均减小 B.a1减小,a2增大
C.a1不变,a2增大 D.a1不变,a2减小
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A
B
C
D
研究目的
压强对反应的影响
(p2>p1)
温度对反应的影响
平衡体系中增加N2的浓度对反应的影响
催化剂对反应的影响
示意图

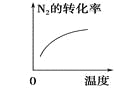
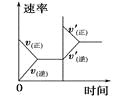
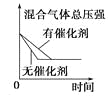
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列溶液一定呈中性的是( )
A.使石蕊试液呈紫色的溶液
B.pH=7的溶液
C.c(H+)=c(OH-)=10-6mol·L-1的溶液
D.酸与碱恰好完全反应生成正盐的溶液
难度: 简单查看答案及解析
-
在CH3COOH
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是( )
A.加入NaOH B.加入纯醋酸 C.加水 D.降低温度
难度: 中等查看答案及解析
-
在某一元酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的某一元酸溶液中c(H+)约为1×10-2mol/L
B.某一元酸能与水以任意比例互溶
C.1mol/L的某一元酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应
D.在相同条件下,某一元酸溶液的导电性比硫酸弱
难度: 中等查看答案及解析
-
在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.溶液的pH
C.电离常数Ka D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
25℃下列四种溶液:①c(H+)=1mol·L-1的醋酸②0.1mol·L-1的盐酸③0.01mol·L-1的NaOH溶液 ④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
难度: 中等查看答案及解析