-
研究化学反应的热效应有利于更好的利用化学能。下列说法正确的是( )
A.放热反应任何条件下一定能自发进行
B.升高温度可以增加分子的活化能
C.生成物总能量高于反应物总能量的反应为放热反应
D.生成物的键能总和大于反应物的键能总和的反应为放热反应
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.将纯水加热后,水的电离程度增大,pH不变
B.反应2H2(g)+O2(g)=2H2O(l)在一定条件能自发进行的原因是ΔS<0
C.常温下,向CaCO3悬浊液中加入少量水,所得新悬浊液中c(Ca2+)减小
D.常温下,将稀CH3COONa溶液加水稀释后,恢复至原温度,pH减小、Kw不变
难度: 简单查看答案及解析
-
下列反应中△H>0,△S>0的是
A.CaCO3(s)=CaO(s)+CO2(g)
B.NH3(g)+HCl(g)=NH4Cl(s)
C.4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
D.任何温度下均能自发进行2H2O2(l)=2H2O(l)+O2(g)
难度: 简单查看答案及解析
-
实验室用锌粒和稀硫酸反应制取氢气,下列措施不能使反应速率加快的是( )
A.降低反应温度
B.滴加少量硫酸铜溶液
C.适当的增加硫酸的浓度
D.锌粉代替锌粒
难度: 简单查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.对N2+3H2
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
难度: 简单查看答案及解析
-
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e-=Cd+2OH-
C.放电时电池内部OH-向负极移动
D.充电时与直流电源负极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
难度: 简单查看答案及解析
-
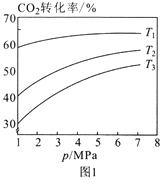
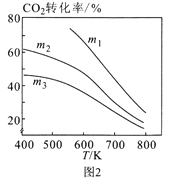
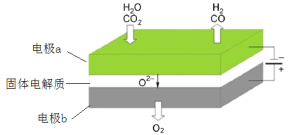
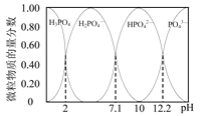
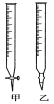
下列图示与对应的叙述不相符合的是( )
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)
CH3OH(g),该反应的ΔH=-91 kJ·mol-1
D.图4表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
难度: 中等查看答案及解析
-
我国的“长三丙火箭”第三级推进器使用的燃料是液态氢。已知在25℃时,2gH2在O2中完全燃烧生成液态水时放出热量285.8kJ。下列有关说法中,正确的是( )
A.H2的燃烧热为–285.8kJ
B.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6kJ·mol–1
C.25℃时,2H2(g)+O2(g)=2H2O(g)的ΔH>–571.6kJ·mol–1
D.25℃时,11.2LH2在O2中完全燃烧生成液态水时放出热量142.9kJ
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
A.
 B.
B.
C.
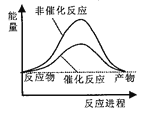 D.
D.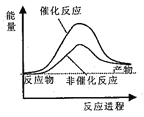
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.电解法精炼铜时应将粗铜板作阳极
B.100℃时,纯水的pH约为6,此时纯水呈酸性
C.电镀时应将待镀物品(镀件)与直流电源的正极相连
D.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的正极相连
难度: 简单查看答案及解析
-
在相同温度下,0.01mol/L的NaOH溶液和0.01mol/L的盐酸相比较,下列说法正确的是( )
A.两溶液的pH之和等于14
B.由水电离出的c(H+)都是1.0×10-12mol/L
C.由水电离出的c(OH-)相等
D.若将0.01mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
难度: 简单查看答案及解析
-
相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X
Y
W
Z
反应体系能量变化
甲
2mol
1mol
放出a kJ/mol
乙
1mol
1mol
放出b kJ/mol
丙
2mol
2mol
放出c kJ/mol
丁
3mol
2mol
吸收d kJ/mol
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
难度: 中等查看答案及解析