-
面对突如其来的新冠病毒,越来越多的人意识到学习化学的重要性。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95口罩所使用的聚丙烯材料属于合成纤维
C.为增强“84”消毒液的消毒效果,可加入稀盐酸
D.我国研制的重组新冠疫苗无需冷藏保存
难度: 简单查看答案及解析
-
W、X、Y、Z 为原子序数依次增大的四种短周期元素,W的简单氢化物可用作制冷剂,Y所在周期数与族序数相同,X与Y为同周期元素,Z原子的最外层电子数与 W 的电子总数相等。下列说法正确的是
A.简单离子半径: W>X>Y>Z B.W、X 的氢化物在常温下均为气体
C.X、Y的最高价氧化物的水化物均为强碱 D.W 与 Z 形成的化合物中只有共价键
难度: 中等查看答案及解析
-
工业上合成乙苯的反应如下。下列说法正确的是
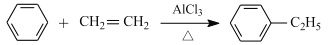
A.该合成反应属于取代反应 B.乙苯分子内的所有C、H 原子可能共平面
C.乙苯的一溴代物有 5 种 D.苯、乙烯和乙苯均可使酸性高猛酸钾溶液褪色
难度: 中等查看答案及解析
-
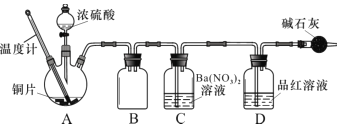
氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3
CrN+3HCl,装置如图所示
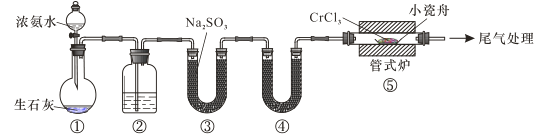
下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.5mol18O2中所含中子数为10NA
B.标准状况下,2.24LCHCl3含有的共价键数为0.4NA
C.常温下,2.8gC2H4与CO的混合气体所含碳原子数为0.3NA
D.0.1mol/LNa2S溶液中,S2-、HS-、H2S的数目共为0.1NA
难度: 中等查看答案及解析
-
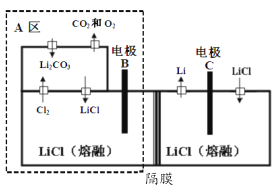
目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是

A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
难度: 中等查看答案及解析
-
如图是H3AsO4水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系。下列说法错误的是( )
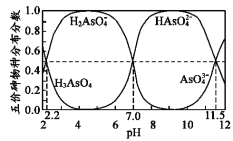
A.NaH2AsO4溶液呈酸性
B.向NaH2AsO4溶液滴加NaOH溶液过程中,c(H2AsO4-)/c(HAsO42-)先增加后减少
C.H3AsO4和HAsO42-在溶液中不能大量共存
D.Ka3(H3AsO4)的数量级为10-12
难度: 中等查看答案及解析
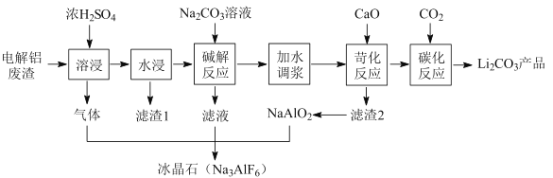
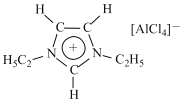

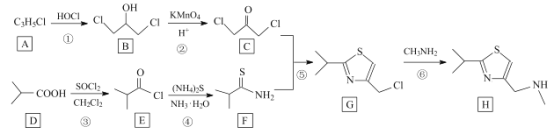
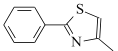 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。