-
在2019年9月25日,北京大兴国际机场正式投运。下列说法不正确的是
A.机场航站楼使用的玻璃为无机非金属材料
B.机场航站楼使用的隔震支座由橡胶和钢板相互粘结而成,属于新型无机材料
C.机场航站楼采用的钢铁属于合金材料
D.机场高速采用了新型自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构所造成的破坏
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.常温下, pH=2的H2SO4 溶液1L中,硫酸和水电离的 H+总数为 0.01NA
B.1mol H2O 最多可形成4NA个氢键
C.用浓盐酸分别和 MnO2、KClO3 反应制备1mol氯气,转移的电子数均为2NA
D.常温常压下, O2 与 O3 的混合气体16g,分子总数为NA
难度: 中等查看答案及解析
-
有机物 X 分子式为C3H6O,有多种同分异构体。其中之一丙醛(液态)的燃烧热为1815kJ/mol。下列说法不正确的是
A.X 的同分异构体中,含单官能团的共 5 种
B.1mol X 最多能和 1mol H2 加成
C.表示丙醛燃烧热的热化学方程式为:C3H6O(l)+4O2(g) = 3CO2 (g)+3H2O(l) △H=+1815kJ/mol
D.X 的同分异构体其中之一 CH2=CHCH2OH 可以发生取代反应、加成反应、加聚反应、氧化反应
难度: 中等查看答案及解析
-
某兴趣小组计划用Al、稀H2SO4、NaOH溶液制备1mol Al(OH)3。设计如下三种方案:
方案Ⅰ:向 Al 中加入 NaOH 溶液,至 Al 刚好完全溶解,得溶液①。向溶液①中加硫酸至刚好沉淀完。过滤、洗涤、干燥。
方案Ⅱ:向 Al 中加入硫酸,至 Al 刚好完全溶解,得溶液②。向溶液②中加 NaOH 溶液至刚好沉淀完。过滤、洗涤、干燥。
方案Ⅲ:将 Al 按一定比例分为两份,按前两方案先制备溶液①和溶液②。然后将两溶液混和。过滤、洗涤、干燥。
下列说法不正确的是
A.三种方案转移电子数一样多
B.方案Ⅲ所用硫酸的量最少
C.方案Ⅲ比前两个方案更易控制酸碱的加入量
D.采用方案Ⅲ时,用于制备溶液①的 Al 占总量的 0.25
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与Z同主族,X为非金属元素,Y的原子半径在第三周期中最大,Y与W形成的离子化合物对水的电离无影响。下列说法正确的是
A.常温下,X的单质一定呈气态
B.非金属性由强到弱的顺序为:X>Z>W
C.X与W形成的化合物中各原子均达到8电子稳定结构
D.Y、Z、W的最高价氧化物对应的水化物可能相互反应
难度: 中等查看答案及解析
-
中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图(质子膜允许H+和 H2O 通过),下列相关判断正确的是
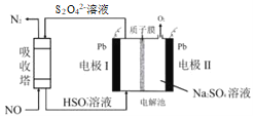
A.电极Ⅰ为阴极,电极反应式为 2H2O+2e- =2OH- +H2↑
B.电解池中质子从电极Ⅰ向电极Ⅱ作定向移动
C.吸收塔中的反应为 2NO+ 2S2O42-+H2O=N2+4HSO3-
D.每处理1molNO电解池质量减少16g
难度: 困难查看答案及解析
-
常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lgc)间的关系如图。下列对该过程相关分析正确的是
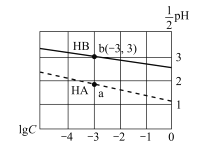
A.HB的电离常数(Ka)数量级为10-3
B.其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C.a、b两点溶液中,水的电离程度b<a
D.当lgc= -7时,两种酸溶液均有pH=7
难度: 困难查看答案及解析
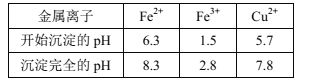
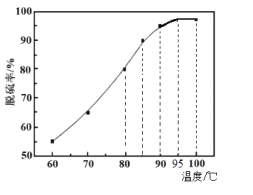
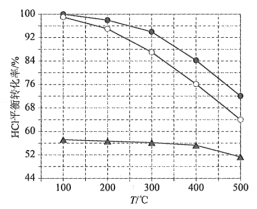
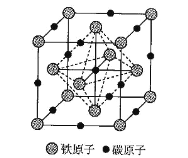
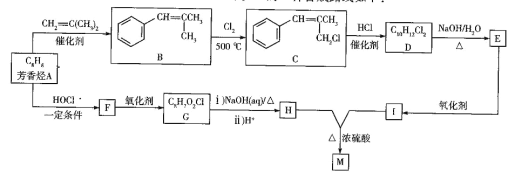
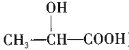 )在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以 2—丁烯和乙烯为原料合成乳酸,设计合成路线:_____________________(无机试剂任选)。
)在医药方面广泛用作防腐剂、载体剂、助溶剂等。参照上述流程,以 2—丁烯和乙烯为原料合成乳酸,设计合成路线:_____________________(无机试剂任选)。