-
元素的性质随着原子序数的递增呈现周期性的变化的根本原因是( )
A. 元素相对原子质量的递增,量变引起质变
B. 元素的金属性和非金属性呈周期性变化
C. 元素原子核外电子排布呈周期性变化
D. 元素化合价呈周期性变化
难度: 中等查看答案及解析
-
氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1+ Q2<2Q3 B.Q1+ Q2>2Q3 C.Q1+ Q2<Q3 D.Q1+ Q2>Q3
难度: 中等查看答案及解析
-
下列每组物质中含有的化学键类型相同的是
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.O2分子间存在着非极性共价键 B.SO2和H2O反应的产物是离子化合物
C.CO2分子内存在着极性共价键 D.盐酸中含有H+ 和Cl‾,故HCl是离子化合物
难度: 中等查看答案及解析
-
下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应
难度: 简单查看答案及解析
-
下列每组中各物质内既有离子键又有共价键的一组是
A.Na2O2、KOH、Na2SO4 B.MgO、Na2SO4、NH4HCO3
C.NaOH、H2SO4、(NH4)2SO4 D.HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列有关周期表的说法正确的是( )
A.短周期是第一、二、三、四周期 B.元素周期表有18个族
C.第ⅠA族的元素全部是金属元素 D.元素周期表含元素最多的族是第ⅢB族
难度: 简单查看答案及解析
-
锂(Li)是世界上最轻的金属,它属于碱金属的一种。下列说法正确的是( )
A.碱金属单质在氧气中燃烧,都生成过氧化物 B.Li是碱金属原子中半径最小的原子
C.Li、Na、K、Rb+ 的最外层都只有一个电子 D.Na+ 比Li多一个电子层
难度: 简单查看答案及解析
-
下列有关碱金属元素和卤素的说法中,错误的是()
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低
难度: 简单查看答案及解析
-
下列关于卤素(用X表示)的叙述中正确的是( )
A.卤素单质的颜色从F2→I2随相对分子质量增大而逐渐加深
B.HX都极易溶于水,HX热稳定性随X的核电荷数增加而增强
C.卤素单质与水反应均可用X2+H2O⇌HXO+HX表示
D.X‾离子的还原性依次为:F‾<Cl‾<Br‾<I‾,因此相对分子质量小的卤素单质均可将相对分子质量大的卤素从其盐溶液中置换出来
难度: 中等查看答案及解析
-
俄罗斯科学家用铪和钨两种核素精确确定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据18272Hf(铪-182)和18274W(钨-182)两种核素的含量比例得出的。下列有关铪-182和钨-182的关系说法正确的是( )
A.中子数相等 B.互为同位素
C.原子质量几乎相同 D.在周期表中处于相邻位置
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子序数之差为2的两种元素不可能位于同一主族
B.位于同一主族相邻的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能是x+4
C.D‾ 核外有36个电子,则D元素位于第四周期第ⅦA族
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x;乙位于第ⅢA族,则乙原子序数可能为x+19
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物碱性X>Y
A.③ B.①②③④ C.①②③ D.②③
难度: 中等查看答案及解析
-
下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强 B.钠、镁、铝的还原性依次减弱
C.HCl、HBr、HI的稳定性依次增强 D.P、S、Cl原子半径逐渐增大
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34 g/mol,Y的最低价氢化物为非电解质.则下列说法中正确的是( )
X
Y
Z
W
Q
A.X的最低价氢化物水溶液显酸性
B.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
C.Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
D.阴离子还原性:W>Q
难度: 中等查看答案及解析
-
元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
B.短周期元素形成简单离子后,最外层都达到8电子稳定结构
C.第三周期元素的最高正化合价等于它所处的主族序数
D.同一元素的最高价氧化物的水化物不可能既表现酸性又表现碱性
难度: 中等查看答案及解析
-
应用元素周期律分析下列推断,其中正确的组合是( )
①第ⅡA族单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.②④⑥ C.③④⑤ D.①③⑥
难度: 简单查看答案及解析
-
下列物质中,含有离子键的是( )
A.Br2 B.CO2 C.HNO3 D.NH4Cl
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.凡是有化学键断裂的过程一定发生了化学反应 B.分子中一定含有共价键
C.仅由非金属元素不可能形成离子化合物 D.离子化合物中可能含有共价键
难度: 简单查看答案及解析
-
三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
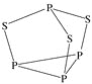
A.该物质中磷元素的化合价为+3
B.22 g P4S3含硫原子数目约为1.806×1023
C.该物质分子结构中S、P最外层电子数均不为8
D.该物质分子中全是极性共价键
难度: 中等查看答案及解析
-
下列有关能量的说法不正确的是 ( )
A.化石能源物质内部贮存着大量的能量
B.植物的光合作用使太阳能转化为化学能
C.燃料燃烧时只是将化学能转化为热能
D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
难度: 中等查看答案及解析
-
下列中和反应中放出热量最多的是( )
A.50 mL 0.3mol/L的硫酸和50mL 0.6mol/L的NaOH溶液相混合
B.80 mL 0.3mol/L的盐酸和80 mL 0.3 mol/L的NaOH溶液相混合
C.80 mL 0.3mol/L的硫酸和80mL 0.3mol/L的NaOH溶液相混合
D.100 mL 0.3mol/L的盐酸和50 mL 0.3 mol/L的NaOH溶液相混合
难度: 简单查看答案及解析
-
SF6 是一种优良的绝缘气体,分子结构中只有S─F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F─F 、S─F键需吸收的能量分别为160 kJ、330 kJ。则1 mol 固体硫单质参加:S(s)+3F2(g)=SF6(g)反应,完全生成SF6(g)的热效应为( )
A.吸收430 kJ B.释放450 kJ
C.释放1220 kJ D.释放1780 kJ
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.凡经加热而发生的化学反应都是吸热反应
B.C(石墨,s) == C(金刚石,s),反应中既没有电子的得失也没有能量的变化
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.伴有能量变化的物质变化,都是化学变化
难度: 中等查看答案及解析
-
下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:

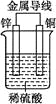
卡片上的描述合理的是( )
A.①②③ B.③④⑤ C.①⑤⑥ D.②③④
难度: 简单查看答案及解析
-
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
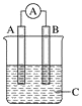
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
难度: 简单查看答案及解析
-
把A、B、C、D四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若A、B 相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此四种金属的活动性由强到弱的顺序为( )
A.A>B>C>D B.A >C >D>B
C.C>A>B>D D.B>A>C>D
难度: 中等查看答案及解析
-
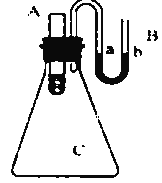
如图为某课外小组自制的氢氧燃料电池,a、b均为石墨。
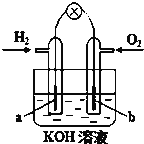
下列叙述不正确的是( )
A.a电极是负极,该电极上发生氧化反应
B.总反应方程式为2H2 + O2 = 2H2O
C.b极反应是O2 + 4H+ + 4e‾ = 4H2O
D.氢氧燃料电池是一种具有应用前景的绿色能源
难度: 中等查看答案及解析
-
下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌锰干电池中,锌电极是负极
C. 氢氧燃料电池可把化学能转化为电能
D. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
难度: 简单查看答案及解析
-
纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液作电解质溶液,电池的总反应为Zn+Ag2O===2Ag+ZnO。关于该电池下列叙述不正确的是( )
A. 正极的电极反应为Ag2O+2e-+H2O===2Ag+2OH-
B. Zn极发生氧化反应,Ag2O极发生还原反应
C. 使用时电子由Zn极经外电路流向Ag2O极,Zn是负极
D. 使用时溶液中电流的方向是由Ag2O极流向Zn极
难度: 中等查看答案及解析