-
YBa2Cu3Ox(Y元素钇)是一种重要超导材料,下列关于
Y的说法错误的是( )
A.质量数是89 B.质子数与中子数之差为50
C.核外电子数是39 D.
Y与
Y互为同位素
难度: 简单查看答案及解析
-
下列化学用语只能用来表示一种微粒的是( )
A.C3H8 B.X- X C.二氯乙烷 D.
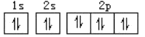
难度: 简单查看答案及解析
-
下列对物质或微粒的表述正确的是( )
A.氯离子的结构示意图:

B.氧化钠的分子式:Na2O
C.碳-14 原子表示为:14C
D.Na2S 的电 子式:Na : S : Na
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.碱性:KOH>NaOH B.金属性:Na>Mg
C.稳定性:HF>CH4 D.酸性:HF<HCl
难度: 中等查看答案及解析
-
X、Y、Z 是同周期的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。则下列说法正确的是( )
A.原子半径: X>Y>Z B.阴离子的还原性: Z>Y>X
C.气态氢化物稳定性: X<Y<Z D.原子序数: Z>Y>X
难度: 中等查看答案及解析
-
形似足球的富勒烯C60可以形成如图的聚合物。该聚合物( )

A.摩尔质量为720n B.熔点高、硬度大
C.属于高分子化合物 D.熔化时破坏范德华力
难度: 简单查看答案及解析
-
同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对于PH4I的叙述中正确的是( )
A.它是一种共价化合物 B.25℃ 时,它的水溶液pH=7
C.它不可能与 NaOH 溶液反应 D.它受热分解时可能会产生有色气体
难度: 中等查看答案及解析
-
下列变化不需要破坏化学键的是( )
A.加热氯化铵固体 B.干冰气化 C.石油裂化 D.氯化氢溶于水
难度: 简单查看答案及解析
-
科学家经过研究后发现,把水加热加压到 374℃、22.lMPa以上时具有很多特性, 如其中含有的氢离子浓度远远大于10-7mol/L,还具有很强的溶解有机物的能力。由此可知,处于这种状态下的水( )
A.显中性, pH一定等于 7 B.表现出非极性溶剂的特性
C.显酸性,pH 一定小于 7 D.表现出极性溶剂的特性
难度: 简单查看答案及解析
-
某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)
2Z(g)+W(s) + Q,下列叙述正确的是
A.加入少量W,υ(逆)增大 B.压强不变时,反应达到平衡状态
C.升高温度,υ(逆)、υ(正)都增大 D.平衡后加入X,方程式中的Q增大
难度: 中等查看答案及解析
-
在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
A.气体的平均分子量不再变化 B.反应的平衡常数不变
C.ʋ(H2) =2 ʋ(HI) D.气体的颜色不再变化
难度: 中等查看答案及解析
-
工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,ʋ(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
难度: 中等查看答案及解析
-
某温度下,一反应平衡常数K=c(CO)•c(H2O)/c(CO2)•c(H2)。恒容时到达平衡后,升高温度,H2浓度减小。下列说法正确的是
A.升温,逆反应速率减小 B.加压,H2浓度减小
C.增加H2,K减小 D.该反应的正反应是吸热反应
难度: 中等查看答案及解析
-
不能用勒夏特列原理解释的是
A.使用铁触媒,加快合成氨反应速率
B.乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利
C.打开汽水瓶盖,即有大量气泡逸出
D.配置FeCl3溶液时,加入少量盐酸
难度: 简单查看答案及解析
-
由于不法分子把地沟油当作食用油, 给人民的健康带来严重危害。但是如何处置地沟油是每个化学工作者义不容辞的任务。2013 年 4 月 24 日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行,并获得成功。下列区分地沟油与航空汽油的方法中正确的是( )
A.具有可燃性的是航空汽油 B.测定沸点,有固定沸点的是航空汽油
C.加入水中浮在水面上的是地沟油 D.加入氢氧化钠溶液共热,不分层的是地沟油
难度: 简单查看答案及解析
-
某研究小组经资料检索后发现,药物贝诺酯能可由乙酸水杨酸和对乙酰氨基酚在一定条件下反应制得,其反应的化学方程式为
 H2O
H2O下列有关叙述错误的是( )
A.贝诺酯、乙酰水杨酸分子中都有酯基
B.对乙酰氨基酚的分子式为C8H9O2N
C.乙酰水杨酸能与NaHCO3溶液反应,并放出二氧化碳气体
D.贝诺酯与足量 NaOH 溶液共热,最终产物之一是乙酰水杨酸钠
难度: 中等查看答案及解析
-
Na、Al、Fe都是重要的金属元素。下列说法正确的是
A.氧化物都是碱性氧化物
B.氢氧化物都是白色固体
C.单质都可以与水反应
D.单质在空气中都形成致密氧化膜
难度: 中等查看答案及解析
-
下列反应能用离子方程式CO32-+2H+==CO2↑+H2O表示的是
A. 石灰石与足量盐酸反应 B. 碳酸钠与足量盐酸反应
C. 碳酸钠与足量醋酸反应 D. 碳酸钡与足量硝酸反应
难度: 中等查看答案及解析
-
下列关于某无色溶液中离子检验的操作、现象与结论对应正确的是( )

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A.32 g S8单质(右图)中含有的S—S键个数为8NA
B.常温下,16gO2和O3的混合气体中所含氧原子数为2.5NA
C.1molMg在空气中完全反应生成MgO、Mg3N2转移电子数为2 NA
D.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA
难度: 中等查看答案及解析

 合成
合成 ___________________(合成路线常用表示方法为:X
___________________(合成路线常用表示方法为:X