-
5 mL物质的量浓度为18 mol·L-1的硫酸中加入足量铜片并加热,充分反应。下列说法正确的是( )
A.有0.09 mol的硫酸被还原 B.有0.045 mol的硫酸被还原
C.充分反应后体系无硫酸剩余 D.消耗的铜的质量一定小于2.88 g
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查
难度: 简单查看答案及解析
-
汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式: BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是( )
A. 用盐的形式表示: BaSiO3·CuSiO3 B. 用氧化物形式表示:BaO·CuO·2SiO2
C. 易溶于强酸、强碱 D. 性质稳定,不易褪色
难度: 中等查看答案及解析
-
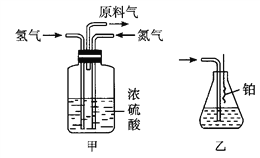
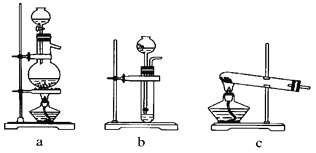
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
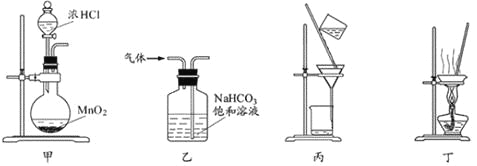
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
表中是食用碘盐包装上的部分说明,下列说法正确的是( )
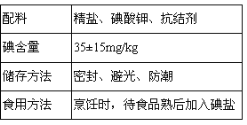
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20mg/kg~50mg/kg
难度: 简单查看答案及解析
-
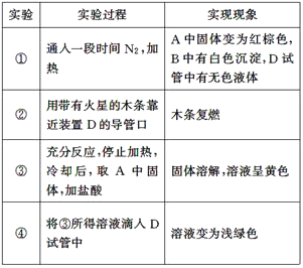
a、b、c、d、e、均可溶于水的固体,组成它们的离子有
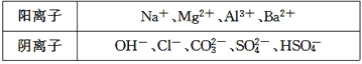
分别取它们的水溶液进行实验。结果如下:
①a溶液与b溶液反应生成白色沉淀,沉淀可溶于e溶液;
②a溶液与c溶液反应生成白色沉淀,沉淀可溶于e溶液;
③a溶液与d溶液反应生成白色沉淀,沉淀可溶于盐酸;
④b溶液与适量d溶液反应生成白色沉淀,加入过量d溶液,沉淀量减少,但不消失。据此推断( )
A.e溶液中一定含有HSO4-
B.a溶液中一定含有Al3+
C.d溶液中一定有SO42-
D.c溶液中可能含有CO32-
难度: 中等查看答案及解析
-
诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸
B.用二氧化硅制取单质硅时,当生成2.24L气体(标准状况)时,得到2.8g硅
C.6g的二氧化硅中含有0.2mol的共价键
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.利用高纯硅可以制成光电池,将光能直接转化为电能
B.CO、CO2均易与血红蛋白结合而中毒
C.从SiO2制备高纯Si的过程反应中只涉及置换反应
D.SiO2和H2O反应可直接制备H2SiO3
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.S→SO3可以一步实现
B.S是淡黄色固体,易溶于水
C.Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S
D.试官壁上残留的S可以用酒精清洗
难度: 中等查看答案及解析
-
硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
难度: 简单查看答案及解析
 B.
B.
 D.
D.