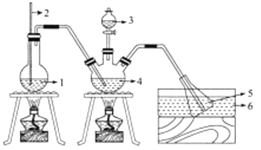
-
主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A. 原子半径:T>R>W>Z
B. T和R形成化合物的水溶液呈碱性
C. 化合物TX具有很强的还原性,可与水反应
D. T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
难度: 中等查看答案及解析
-
[宁夏石嘴山市第三中学2019届三模]化学与生活、生产、社会可持续发展密切相关,下列有关说法正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应
B. 石油裂解制取乙烯、丙烯等化工原料不涉及化学变化
C. 电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
D. 我国发射的“嫦娥三号”卫星中使用的碳纤维复合材料,是一种有机高分子材料
难度: 中等查看答案及解析
-
异丙烯苯和异丙苯是重要的化工原料,二者存在如图转化关系:

下列说法正确的是
A.异丙烯苯分子中所有碳原子一定共平面
B.异丙烯苯和乙苯是同系物
C.异丙苯与足量氢气完全加成所得产物的一氯代物有6种
D.0.05mol异丙苯完全燃烧消耗氧气13.44L
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 向1L0.5mol/L盐酸溶液中通入NH3至中性(忽略溶液体积变化),此时NH4+个数为0.5NA
B. 向含有FeI2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应中转移电子数目为3NA
C. 标准状况下,22.4L二氯甲烷中含有4NA极性共价键
D. 用惰性电极电解CuSO4溶液,标况下,当阴极生成22.4L气体时,转移的电子数为2NA
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀
H2S酸性比H2SO4强
B
将木炭和浓硫酸共热生成的气体通入澄清石灰水中,澄清石灰水变浑浊
该气体一定是CO2
C
向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO42-
D
向1 mL 浓度均为0.1 mol·L−1 的MgSO4和CuSO4混合溶液中,滴入少量0.1 mol·L−1 NaOH溶液,先产生蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
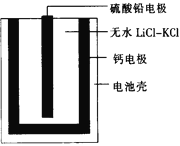
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
难度: 中等查看答案及解析
-
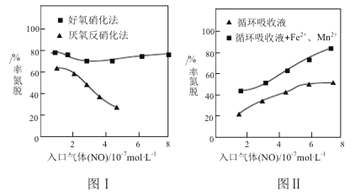
常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是
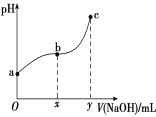
A.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.b~c段,随NaOH溶液的滴入,
逐渐增大
D.若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
难度: 中等查看答案及解析

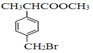 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下: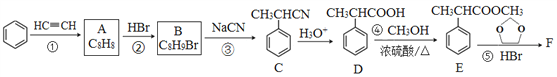
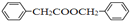 的合成路线_________________。
的合成路线_________________。