-
下列操作不能达到目的的是
选项
目的
操作
A.
配制100 mL 1.0 mol/L CuSO4溶液
将25 g CuSO4·5H2O溶于100 mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将MnO4-完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
难度: 简单查看答案及解析
-
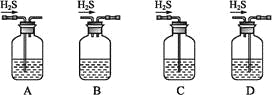
对实验Ⅰ~Ⅳ的实验现象预测正确的是
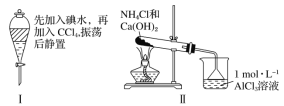

A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
难度: 中等查看答案及解析
-
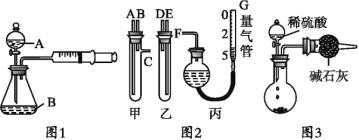
下列有关实验原理或实验操作正确的是
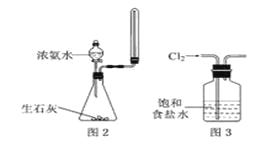
A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
难度: 中等查看答案及解析
-
下列有关实验的叙述中正确的是( )
A.向溴水和碘水中分别加入少量CCl4,振荡后静置,下层的颜色都比上层深
B.用过量的NaOH溶液除去FeCl2溶液中的FeCl3
C.用托盘天平准确称取0.400 0 g食盐,配成500 mL浓度为0.020 0 mol·L-1的食盐水
D.某气体能使品红溶液褪色,则该气体一定是SO2
难度: 中等查看答案及解析
-
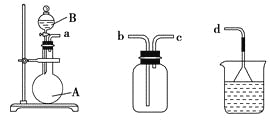
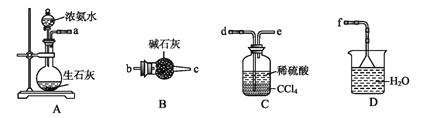
下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.
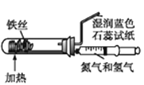 模拟工业制氨气检验产物
模拟工业制氨气检验产物B.
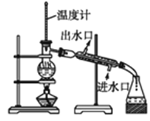 分离沸点不同的两种液体
分离沸点不同的两种液体C.
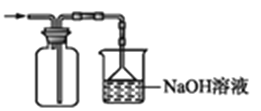 收集并吸收多余的氯气
收集并吸收多余的氯气D.
 盛放浓硝酸
盛放浓硝酸难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.仰视量筒刻度量取一定量浓硫酸所配制的0.1 mol·L-1H2SO4溶液的浓度结果偏高
B.利用沸点数据推测将一些液体混合物分离开来的可能性
C.要将溶解在CCl4中的碘分离出来,可以用蒸馏法,因为碘易升华,先分离出来
D.欲检验Br-,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色
难度: 中等查看答案及解析