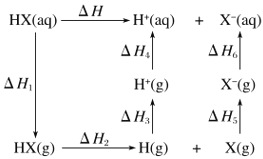
-
元素的原子核外有四个电子层,其3d能级上的电子数是4s能级上的3倍,则此元素是( )
A. S B. Fe C. Si D. Cl
难度: 简单查看答案及解析
-
根据价层电子对互斥理论及原子轨道的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()
A.直线形 sp杂化 B.三角形 sp2杂化
C.三角锥形 sp2杂化 D.三角锥形 sp3杂化
难度: 中等查看答案及解析
-
下列各种说法中错误的是( )
A.形成配位键的条件是一方有空轨道,一方有孤电子对
B.配位键是一种特殊的共价键
C.配位化合物中的配体可以是分子也可以是阴离子
D.共价键的形成条件是成键原子必须有未成对电子
难度: 简单查看答案及解析
-
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 简单查看答案及解析
-
根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说明中正确的是()
A.溴、碘单质和四氯化碳中都含有卤素
B.溴、碘是单质,四氯化碳是化合物
C.Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D.以上说法都不对
难度: 中等查看答案及解析
-
下列各组元素属于P区的是( )
A.原子序数为1、2、7的元素 B.
、
、Cl
C.O、S、P D.Na、Li、Mg
难度: 简单查看答案及解析
-
下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是
A. 核内无中子的原子
B. 外围电子构型为3s23p4的原子
C. 核外电子排布图为
的基态原子
D. 处于激发态时其原子的电子排布式可能为1s22s22p63s13p2
难度: 中等查看答案及解析
-
下列电子排布图所表示的元素原子中,其能量处于最低状态的是 ( )
A.
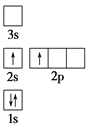 B.
B.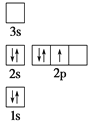 C.
C.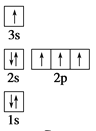 D.
D.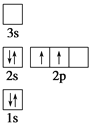
难度: 中等查看答案及解析
-
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”时更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②
容易失去电子转变为
,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为
而不是
④某种激发态碳(C)原子的电子排布式为
而不是
A.①③ B.②③ C.③④ D.①②③④
难度: 简单查看答案及解析
-
甲醛分子的结构式如图所示,下列描述正确的是( )
A.甲醛分子中有4个σ键
B.甲醛分子中的C原子为sp3杂化
C.甲醛分子中的O原子为sp杂化
D.甲醛分子为平面三角形,有一个π键垂直于三角形平面
难度: 简单查看答案及解析
-
等电子体之间结构相似、物理性质也相近,根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体,下列各组粒子不能互称为等电子体的是( )
A.
和
B.
和
C.
和
D.
和
难度: 简单查看答案及解析
-
是一种无色剧毒气体,其分子结构和
相似,但
键键能比
键键能低。下列判断不正确的是( )
A.
分子稳定性低于
分子,因为
键键能高
B.
分子中P是
杂化
C.
沸点低于
沸点,因为
键键能低
D.
分子呈三角锥形
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.一般情况下,σ键比π键的电子云重叠程度大,形成的共价键强
B.碳碳双键的键能不是碳碳单键键能的2倍
C.s—s σ键与s—p σ键的电子云的成键方式相同
D.
分子中有一个σ键,2个π键
难度: 简单查看答案及解析
-
许多过渡金属离子对多种配位体有很强的结合力,能形成种类繁多的配合物。下列说法正确的是( )
A. 向配合物[TiCl(H2O)5]Cl2·H2O溶液中加入足量的AgNO3溶液,所有的Cl-均被完全沉淀
B. 配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂,则固态Ni(CO)4属于分子晶体
C. 配合物[Cu(NH3)4]SO4·H2O的配位体为NH3和SO42-
D. 配合物[Ag(NH3)2]OH的配位数为6
难度: 中等查看答案及解析
-
下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项
分子
空间构型
杂化方式
孤电子对数
A
NH3
平面三角形
sp3杂化
N含有一对孤电子对
B
CCl4
正四面体
sp3杂化
C不含有孤电子对
C
H2O
V形
sp2杂化
O含有两对孤电子对
D
CO32-
三角锥形
sp3杂化
C含有一对孤电子对
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下面说法中,正确的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.在
、
和
中都存在配位键
C.丙烯(
)分子中3个碳原子都是
杂化
D.
和
都是正四面体分子且键角都为
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
分子中σ键与π键的数目比为
且σ键比π键重叠程度大,形成的共价键强
B.
和
均为V形的极性分子
C.①
②
③
④
⑤
中存在配位键的是①②⑤
D.
和
的中心原子均为
杂化
难度: 中等查看答案及解析
-
某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性分别为3.44和3.98,已知AB2分子的键角为103.3o。下列推断不正确的是
A.AB2分子的空间构型为V形
B.AB2与H2O相比,AB2的熔、沸点比H2O的低
C.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
D.A—B键为极性共价键,AB2分子为非极性分子
难度: 简单查看答案及解析
-
利用“相似相溶”这一经验规律可说明的事实是
①HCl易溶于水 ②NH3易溶于水 ③N2难溶于水 ④HClO4是强酸 ⑤盐酸是强酸 ⑥氢氟酸是弱酸 ⑦HF很稳定
A.①②③ B.④⑤⑥ C.⑥⑦ D.④⑤
难度: 简单查看答案及解析
-
下列事实与氢键没有关系的是( )
A.
比
更难分解
B.HF的熔、沸点高于HCl
C.酒精可以和水以任意比例互溶
D.邻羟基苯甲醛的沸点低于对羟基苯甲醛
难度: 简单查看答案及解析
-
下列各组分子中,按共价键极性由强到弱排序正确的是( )
A.HF H2O NH3 CH4 B.CH4 NH3 H2O HF
C.H2O HF CH4 NH3 D.HF H2O CH4 NH3
难度: 简单查看答案及解析
-
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )
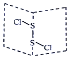
A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
难度: 中等查看答案及解析
-
已知H2O2分子的空间结构可在二面角中如图所示,下列有关H2O2结构的说法正确的是( )
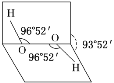
A. H2O2中有3个σ键、1个π键
B. H2O2为非极性分子
C. H2O2中氧原子为sp杂化
D. H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键
难度: 中等查看答案及解析
-
下列各组分子中,都属于含有极性键的非极性分子的是
A.HCl和NH3 B.BeCl2和N2 C.CH4 和C2H4 D.CS2和H2O
难度: 简单查看答案及解析
-
下列现象与氢键有关的是( )
①
的熔、沸点比
的高
②乙醇能与水以任意比混溶,而乙硫醇(
)微溶于水
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤
比
稳定
⑥接近沸点的水蒸气的相对分子质量测量值大于实际值
A.①②③④⑥ B.①②③④⑤ C.②③④⑤ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键 B.分子间存在的较强的电性作用
C.直接影响物质的熔、沸点 D.稀有气体的原子间存在范德华力
难度: 简单查看答案及解析
-
下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.
的稳定性很强,是因为其分子间能形成氢键
D.
 由图可知酸性:
由图可知酸性:,是因为
分子中有1个非羟基氧原子
难度: 中等查看答案及解析