-
下列说法正确的是
A. 氯气具有强氧化性,能与铁反应生成FeCl3,所以液氯不可用钢瓶储存。
B. 有浓硫酸参与的反应都是氧化还原反应
C. 硅酸钠溶液俗称“水玻璃”,长期露置在空气中生成乳白色凝胶状沉淀
D. 硫在足量空气中燃烧生成大量SO3
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应又是放热反应的是( )
①过氧化钠与水反应 ②氨水与稀硫酸的反应
③灼热的炭与CO2反应④Ba(OH)2⋅8H2O与NH4Cl的反应
⑤甲烷在O2中的燃烧 ⑥灼热的炭与水蒸气反应
⑦铝片与稀硫酸反应 ⑧铝热反应
⑨煅烧石灰石制生石灰 ⑩钾与水的反应
A. ①⑤⑦⑧⑩ B. ①③⑤⑦⑩ C. ①②⑤⑦⑧⑩ D. ①③⑤⑥⑦⑩
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有吸水性
B.浓硝酸保存在棕色的细口瓶中,并置于低温阴暗处
C.金属钠着火燃烧时,可用泡沫灭火器灭火
D.正常雨水pH等于7,酸雨的pH小于7
难度: 中等查看答案及解析
-
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况)
B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL
C.原稀硝酸的物质的量浓度一定为4 mol/L
D.参加反应金属总质量(m)为9.6g>m>3.6g
难度: 困难查看答案及解析
-
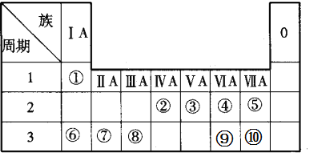
下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期ⅡA族
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表:
元素
X
Y
Z
W
原子半径/pm
186
143
75
71
主要化合价
+1
+3
+5、+3、-3
-1
下列叙述正确的是( )
A.X、Y元素的金属性X<Y
B.Z的气态氢化物比W的气态氢化物稳定
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素对应的简单离子的离子半径大小顺序为Z3->W->X+>Y3+
难度: 困难查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加稀NaOH溶液,将红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
D
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法不正确的有几个( )
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③18gH2O中含有的中子数为10NA
④标准状况下,等体积CH4和HF所含的分子数相同
⑤通过化学变化可以实现16O与18O之间的相互转化
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
下列有关物质用途的说法中,错误的是( )
A.
用于自来水消毒 B.
用作红色油漆和涂料
C.
用于漂白纸浆 D.
用于呼吸面具作供氧剂
难度: 简单查看答案及解析
-
下列化学用语的书写,正确的是
A.氯原子的结构示意图:
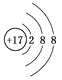
B.6个质子8个中子的碳元素的核素符号:12C
C.氯化镁的电子式:
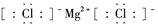
D.用电子式表示氯化氢的形成过程:

难度: 困难查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: H+、Na+、MnO
、SO
B. 碱性溶液中:Na+、K+、SiO
、NO
C. 能溶解Al2O3的溶液中:Mg2+、Cu2+、HCO
、Cl-
D. 含有Fe2+的溶液中:H+、Ca2+、NO
、AlO
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是()
A.向澄清的石灰水中通入SO2气体:Ca2++SO2=CaSO3↓
B.过量SO2气体通入氢氧化钠溶液中:SO2+OH-=HSO3-
C.SO2气体通入溴水中:SO2+Br2+H2O=2H++2Br-+SO32-
D.氢硫酸中通入氯气:S2-+Cl2=S↓+2Cl-
难度: 中等查看答案及解析
-
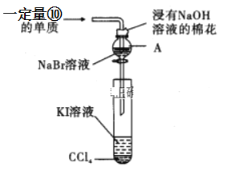
海带中所含碘元素以碘离子(I-)的形式存在,经常食用海带可以防治甲状腺肿大。某同学设计实验从海带中提取碘,有如下操作:①滤液中滴加稀硫酸和双氧水;②在海带中加入少量酒精,使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液;⑥蒸馏。下列说法不正确的是( )

A.实验的合理操作顺序是②④①③⑤⑥
B.步骤②、④中都需要用到玻璃棒
C.步骤①中双氧水表现氧化性
D.通常用如图所示装置蒸馏,产品中易混有高沸点杂质
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
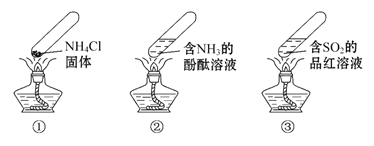
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
下列反应对应离子方程式正确的是( )
A.NO2溶于水:2NO2+H2O=2H++NO3-+NO
B.向KI溶液中加入少量溴水:Br2+2I-=2Br-+I2
C.NH4HCO3与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O
D.向NaClO溶液中滴加少量FeSO4溶液:2Fe2++2H++ClO-=Cl-+2Fe3++H2O
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.将足量Zn与100mL18mol/L浓硫酸反应,生成224mL气体,转移电子为0.02NA
B.32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.1molNa2O2固体中含离子总数与1molCH4中所含共价键数目相等
D.1molD318O+(其中D代表
H)中含有的中子数为10NA
难度: 困难查看答案及解析
-
生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其储存能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,已知键能是指断开1mol化学键变为气态原子时所需要的能量,或形成1mol化学键时所释放的能量。以下是几种化学键的键能:
化学键
N≡N
F—F
N—F
键能/kJ∙mol-1
941.7
154.8
283.0
下列说法中正确的是( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)=2NF3(g)是吸热反应
D.NF3吸收能量后如果没有化学键的断裂与形成,仍可能发生化学反应
难度: 中等查看答案及解析
-
“空气吹出法”海水提溴的工艺流程如图:

下列说法中,不正确的是( )
A.海水提溴发生的所有反应均为氧化还原反应
B.每提取1mol溴,理论上消耗氯气44.8升
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中还发生了化学变化
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )

A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
难度: 中等查看答案及解析
-
将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2mol•L-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8 B.19.2 C.25.6 D.51.2
难度: 中等查看答案及解析