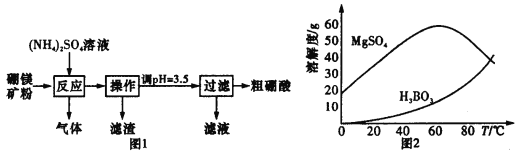
-
化学与生活息息相关,下列有关说法错误的是
A.铝不易被腐蚀,是因为铝易在空气中形成致密的氧化铝膜
B.用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
C.塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应
D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒
难度: 中等查看答案及解析
-
辉银矿的主要矿物成分是黑色硫化银。明代宋应星在《天工开物》下卷“五金”中记载辉银矿:“……形如煤炭,而不甚黑。付与冶工,高者六七两一斗,礁砂放光甚者,得银偏少。凡礁砂入炉,先行拣净淘洗”,下列说法不正确的是
A.“形如煤炭,而不甚黑”,是指辉银矿外形像煤,但没有煤那么黑
B.“高者六七两一斗”,是指辉银矿中银的含量
C.“礁砂放光甚者,得银偏少”,是指含杂质偏多的辉银矿,冶炼得到的银较少
D.“凡礁砂入炉,先行拣净淘洗”中既涉及物理变化又涉及化学变化
难度: 简单查看答案及解析
-
下列说法正确的是
A.盐酸、烧碱、食盐和水分别属于酸、碱、盐和氧化物
B.碳酸钙、水和乙醇分别属于强电解质、弱电解质和非电解质
C.强弱电解质的判断依据是其水溶液的导电性的强弱
D.在复分解反应中,强酸一定可以与弱酸盐反应制取弱酸
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
难度: 中等查看答案及解析
-
半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是
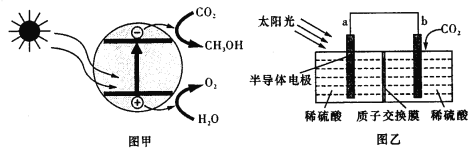
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-
CH3OH+H2O
难度: 困难查看答案及解析
-
下列有关反应热的叙述正确的是
A.由
的
键能、
的
键能、
的
键能,可计算
的燃烧热
B.取
溶液
及
,分别与
的
盐酸反应,计算得出的中和热不相等
C.由氢气、乙烯、乙烷的燃烧热,可计算
的焓变
D.催化剂可同时改变一个化学反应的活化能及焓变
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中A、C、D、E为短周期元素,最外层电子数之和为23,下列说法正确的是

A.元素A的氢化物,在同族元素中沸点最低
B.元素B的金属性比E弱
C.A、C、D均可形成18e-分子
D.与金属钠的反应中,1mol C原子和1 mol E原子得电子数目一定相等
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质问转化均能实现的是
A.SiO2(s)
H2SiO3(S)
Na2SiO3(aq)
B.Cu2S(s)
Cu(s)
CuCl2(s)
C.Fe(s)
Fe2O3(s)
Fe2(SO4)3
D.NaCl(aq)
Na2CO3(s)
NaOH(aq)
难度: 中等查看答案及解析
-
根据下列实验操作和现象,能得出正确结论的是

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
向含有KIO3的淀粉溶液中逐滴加入KHSO3溶液。下列说法中错误的是
A.早期滴加KHSO3溶液时发生的反应:
+
+I2+3H++H2O
B.滴加一定量的KHSO3溶液后,溶液中可能同时含有I-和
C.后期滴加KHSO3溶液,溶液中的反应为:
+I2+H2O
+2I-+3H+
D.在不断滴加KHSO3溶液的过程中,溶液先变蓝,最终蓝色褪去
难度: 中等查看答案及解析
-
已知反应H2(g)+Br2(g)
2HBr(g)分下列三步进行,有关键能如下表所示:

①Br2
2Br(快反应) △H1,K1
②Br+H2
HBr+H(慢反应) △H2,K2
③H+Br
HBr(快反应) △H3,K3
则下列说法错误的是
A.△H1>△H2>△H3
B.25℃时:K1>K3
C.H2(g)+Br2(g)
2HBr(g)的速率由反应②的速率决定
D.H2(g)+Br2(g)
2HBr(g) △H<0
难度: 中等查看答案及解析
-
根据AgCl、Ag2CrO4的溶度积可得到下图,测量溶液中Cl-的量,常使用AgNO3溶液滴定,Na2CrO4作指示剂。下列表述错误的是
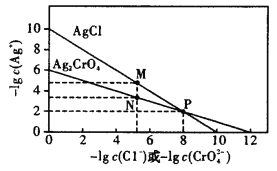
A.由图可知,Ag2CrO4的溶度积小于AgCl的溶度积
B.由图可知,作Cl-的滴定指示剂时,Na2CrO4的浓度不能过大
C.由图可知,只有当c(Ag+)>10-2mol·L-1时,
先沉淀
D.不采用AgNO3溶液滴定测量溶液中I-的量,因为生成的AgI胶体会大量吸附I-,使滴定终点提前
难度: 困难查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
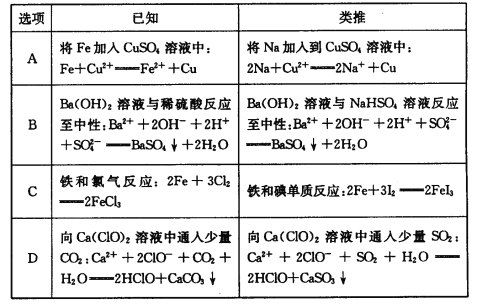
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某溶液中可能含有K+、Fe2+、Ca2+、
、
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
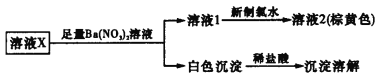
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
难度: 中等查看答案及解析
-
铜镁合金完全溶解于
、密度为
、质量分数为
的浓硝酸中,得到
气体
标准状况
,向反应后的溶液中加入适量的
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
难度: 困难查看答案及解析
-
已知亚磷酸(H3PO3)为二元弱酸,25℃时,向Na2HPO3溶液中滴入盐酸,混合溶液中的有关粒子浓度之比的对数与溶液pH的关系如图所示,下列叙述正确的是

A.M、W两点所在的直线表示pH与
的变化关系
B.当溶液呈中性时,可能存在:c(Na+)>c(
)+2c(
)
C.图中N点表示加入的HCl的物质的量与原溶液中Na2HPO3物质的量相等
D.25℃时,
+H2O
+OH-的平衡常数为1.0×10-12.57
难度: 困难查看答案及解析