-
化学与社会、生产、生活紧切相关。下列说法正确的是( )
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
难度: 简单查看答案及解析
-
NA表示阿伏伽德罗常数,下列判断正确的是( )
A.在18 g18O2中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 mol Cl2参加反应转移电子数一定为2 NA
D.含NA个Na+ 的Na2O溶解于1L水中,Na+ 的物质的量浓度为1mol·L—1
难度: 中等查看答案及解析
-
下列类型的反应,一定发生电子转移的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 中等查看答案及解析
-
依据元素周期表示元素周期律,下列推断正确的是( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl, HBr, HI的热稳定性依次增强
D.若M+ 和R2- 的核外电子层结构相同,则原子序数:R>M
难度: 中等查看答案及解析
-
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径,X元素为( )
A.Al B.P C.Ar D.K
难度: 中等查看答案及解析
-
下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA阿伏加德罗常数)
难度: 中等查看答案及解析
-
下列变化需克服相同类型作用力的是( )
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素,下列说法正确的是( )
A.原子半径的大小顺序: r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
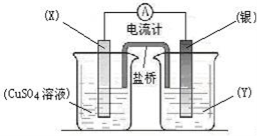
图中,两电极上发生的电极反应分别为:a极:Ag++e-=Ag b极:Fe-2e-=Fe2+;下列说法不正确的是( )
A.a、b可能是同种电极材料
B.该装置一定是电解池
C.装置中电解质溶液一定含有Ag+
D.装置中发生的反应方程式一定是Fe+2Ag+==Fe2++2Ag
难度: 中等查看答案及解析
-
下列反应的离子方程式,正确的是( )
A.
溶液与
溶液混合:
↓
B.醋酸除水垢:
↑+
C.漂白粉溶液中通入过量的
↓+
D.少量金属钠放入冷水中:
↑
难度: 中等查看答案及解析
-
在下列溶液中,能常量共存的离子组是 ( )
A.能使pH试纸显蓝色的溶液中:
、
、
、
B.常温下
的溶液中:
、
、
、
C.含有大量
的溶液中:
、
、
、
D.无色溶液中能大量共存:CO32-、K+、H+、Cl-
难度: 中等查看答案及解析
-
某溶液大量含有的离子仅有:
、
、
和M离子,且
、
、
和M离子的物质的量之比为2:4:1:1,则M离子是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列判断正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8
C.若
,则氧化性:A2 > D2
D.CO2和SiO2都是酸性氧化物,都不能和氧化钙反应
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.用洁净的玻璃棒蘸取试液,点在湿润的pH试纸上测定试液pH
B.将称量好的固体直接加入容量瓶中,加水溶解并稀释至刻度,配制成一定物质的量浓度的溶液
C.欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
难度: 中等查看答案及解析