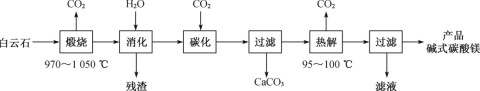
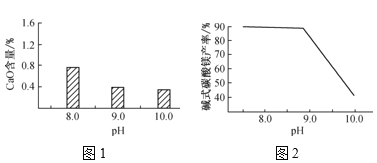
-
化学与生产、生活、社会密切相关。下列说法正确的是( )
A.二氧化硫可用作葡萄酒的食品添加剂
B.漂白粉长期放置在空气中会被空气中的氧气氧化而变质
C.通讯领域中的光导纤维可长期浸泡在强碱性溶液中
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.“墙塌压糖,去土而糖白”中的脱色过程发生了物理变化
B.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是NaOH
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 中等查看答案及解析
-
下列有关化学用语的表述正确的是
A.37Cl-的结构示意图
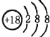 B.中子数为 7 的碳原子: 76C
B.中子数为 7 的碳原子: 76CC.NH3 的结构式:
D.次氯酸的电子式
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A.Si的熔点高,可用作半导体材料
B.HClO具有强氧化性,可用于漂白有色有机物质
C.FeCl3溶液显酸性,可用于蚀刻铜制电路板
D.Al2O3硬度很大,可用于制造耐火材料
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.金刚石、石墨、14C是碳元素的同素异形体
D.混合物:淀粉、自来水、水玻璃、医用酒精
难度: 简单查看答案及解析
-
某学生以铁丝和Cl2为原料进行下列三个实验。下列分析正确的是( )
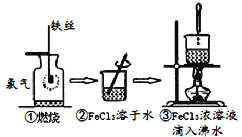
A.实验①反应的火焰为苍白色
B.实验③反应制得的物质为纯净物
C.实验③得到的物质可能产生丁达尔现象
D.实验②、③得到的分散系中分散质粒子的直径:②>③
难度: 简单查看答案及解析
-
以下物质间的每一步转化能通过一步反应实现的( )
A.Fe2O3→FeCl3→FeCl2 B.Si→SiO2→H2SiO3→Na2SiO3
C.C→CO→H2CO3→CO2 D.Al→Al2O3→Al(OH)3→NaAlO2
难度: 简单查看答案及解析
-
某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
难度: 中等查看答案及解析
-
下列操作正确且能达到实验目的是( )
A.制取氢氧化亚铁并观察其颜色
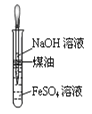
B.制备无水氯化镁
C.比较两种物质的热稳定性
D.制取收集干燥纯净NH3
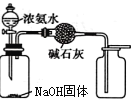
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1L 0.1mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
B.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C.将1L 0.1mol•L-1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D.常温下,NH4+数目:1L 0.5mol•L-1NH4Cl溶液等于2L 0.25mol•L-1NH4Cl溶液
难度: 中等查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
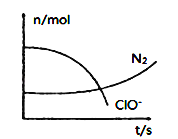
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
难度: 困难查看答案及解析
-
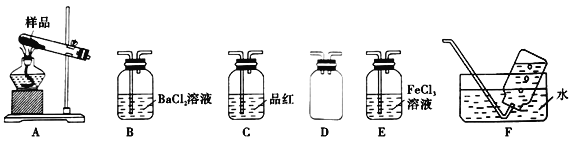
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
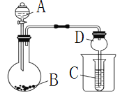
A.若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C.若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D.若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
难度: 中等查看答案及解析
-
下列反应的离子方程式的书写正确的是( )
A.氧化钠投入水中:O2-+H2O=2OH-
B.FeCl3溶液与KI反应:2Fe3++2KI=2Fe2++I2+2K+
C.过量硫酸氢铵与氢氧化钡反应:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
D.少量CO2 通入到 NaClO溶液中:H2O+CO2+2ClO-=2HClO+CO32-
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.pH为1的溶液:Cu2+、Na+、Mg2+、NO3-
B.滴加石蕊溶液显红色的溶液:Fe3+、NH4+、Cl-、S2-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、AlO2-、NO3-、Al3+
难度: 中等查看答案及解析
-
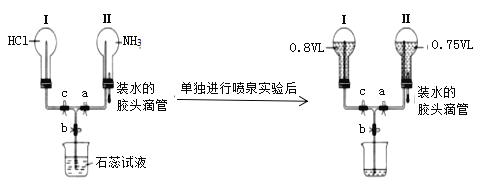
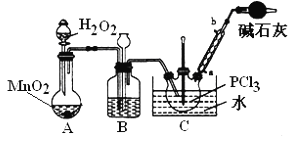
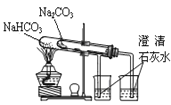
实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdCl2溶液遇CO能产生黑色的Pd),下列说法错误的是( )

A.装置①可改用启普发生器
B.装置⑤中石灰水变浑浊后,再点燃酒精灯
C.装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HCl
难度: 中等查看答案及解析
-
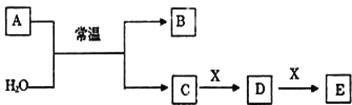
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
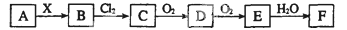
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
下列各项反应对应的图象正确的是( )
A.25℃时,向亚硫酸溶液中通入氯气
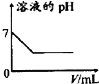
B.向NaAlO2溶液中通入HCl气体
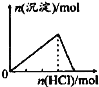
C.向少量氯化铁溶液中加入铁粉
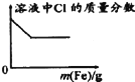
D.向NaOH、Ba(OH)2、NaAlO2的混合液中通入CO2
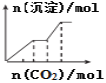
难度: 中等查看答案及解析
-
我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高

B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类
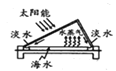
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应
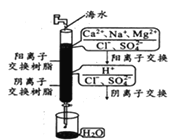
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变

难度: 中等查看答案及解析