-
为探究NaHCO3、Na2CO3与1mol/L盐酸反应过程中的热效应,实验测得如下数据:
序号
试剂/35 mL
固体
混合前温度/℃
混合后温度/℃
①
水
2.5g (0.030mol) NaHCO3
20.0
18.5
②
水
3.2g (0.030mol) Na2CO3
20.0
24.3
③
盐酸
2.5g NaHCO3
20.0
16.2
④
盐酸
3.2g Na2CO3
20.0
25.1
由此得出的结论错误的是
A. Na2CO3溶液与盐酸的反应是放热反应
B. HCO3-(aq)+H+(aq)=CO2(g)+H2O(1) △H>0
C. 含2.5gNaHCO3的饱和溶液(20.0℃)和35mL1mol/L'盐酸(20.0℃)混合后的温度将高于16.2℃
D. 含3.2gNa2CO3的饱和溶液(20.0℃)和35mL1mol/L 盐酸(20.0℃)混合后的温度将高于 25. 1℃
难度: 中等查看答案及解析
-
以下各条件的改变可确认发生了化学平衡移动的是
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,加入了催化剂
难度: 中等查看答案及解析
-
“一次能源与二次能源”的叙述中正确的是( )
①直接从自然界中取得的能源都是一次能源
②二次能源是由一次能源加工、转换而得到
③太阳能、风能、地热能、氢能等都是一次能源
④煤、石油、天然气等化石能源都是一次能源
⑤电能是一种应用最广、污染最小的二次能源
⑥蒸汽能、机械能、水电、核电等都是二次能源
A.①②③⑤ B.①③④⑥ C.①②④⑤⑥ D.②③④⑤⑥
难度: 简单查看答案及解析
-
探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验
现象

a.Al片表面附着蓬松的红色固体
b.产生无色气体,起始速率较慢,之后加快
c.反应放热
d.烧杯底部产生少量不溶于稀盐酸的白色沉淀
e.溶液pH降低
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率
难度: 中等查看答案及解析
-
下列关于可逆反应:A(g)+3B(g)
2C(g) △H<0,下列叙述正确的( )
A.增大反应物的浓度,可以提高活化分子百分数,所以v(正)会增大,v(逆)会减小
B.升高温度可以提高物质的能量,提高活化分子百分数,所以v(正)、v(逆)都增大
C.采用催化剂,可以提高活化分子百分数,所以会引起v(正)、v(逆)同时增大,并改变反应的热效应
D.减小压强可以降低单位体积内活化分子的数目,所以v(正)减小、v(逆)增大
难度: 中等查看答案及解析
-
下列有关化学用语叙述中不正确的是( )
A.NH4H的电子式为
,NH4H中的H-半径比锂离子半径大
B.NH4H晶体既有共价键又有离子键
C.N2的电子式:
,二氧化碳分子的结构式为O-C-O
D.镁-24原子表示为
Mg,S原子的结构示意图
难度: 简单查看答案及解析
-
已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P-P:198,Cl-Cl:243,P-Cl:331。
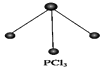
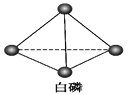
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热ΔH为( )
A.+1326kJ B.-2316kJ
C.-2316kJ/mol D.-1326kJ/mol
难度: 中等查看答案及解析
-
下列各项比较错误的是( )
A.微粒半径:r(Na+)>r(Mg2+)>r(Al3+)
B.酸性强弱:HClO4>H2SO4>H2CO3
C.稳定性:HF>H2O>H2S
D.碱性强弱:Mg(OH)2>Ca(OH)2>Ba(OH)2
难度: 中等查看答案及解析
-
一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥
C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
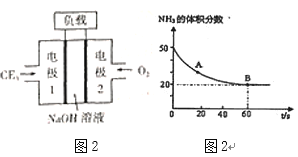
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
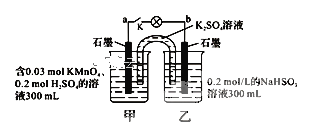
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1mol•L-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
难度: 中等查看答案及解析
-
有四种燃料电池:
下面是工作原理示意图,其中正极反应生成水的是
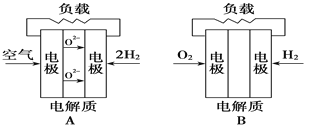
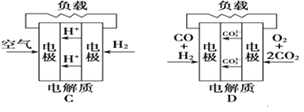
A.固体氧化物燃料电池
B.碱性氢氧化物燃料电池
C.质子交换膜燃料电池
D.熔融盐燃料电池
难度: 中等查看答案及解析
-
断裂1 mol化学键所需的能量如下:
化学键
N—N
O=O
N≡N
N—H
键能(kJ)
154
500
942
a
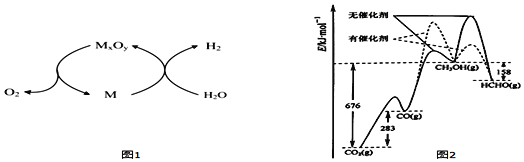
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是
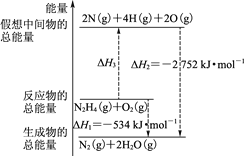
A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.表中的a=194
D.图中的ΔH3=+2218 kJ·mol-1
难度: 中等查看答案及解析
-
流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4===CuSO4+PbSO4+2H2O。下列说法不正确的是( )

A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-===Cu2+
D.调节电解质溶液的方法是补充CuSO4
难度: 中等查看答案及解析
-
近年来AIST报告正在研制一种“高容量、低成本”锂铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-。下列说法不正确的是( )
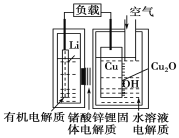
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
难度: 困难查看答案及解析
-
如下图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL。在相同温度、压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。达平衡时,A的体积为1.4aL。下列说法错误的是( )
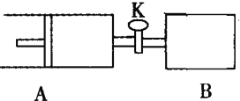
A.反应速率:v(B)>v(A)
B.A容器中X的转化率为80%
C.平衡时的压强:PB=PA
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
难度: 中等查看答案及解析