-
化学是现代生产、生活与科技的中心学科之一,下列与化学有关的说法,错误的是( )
A.PM2.5是指空气中直径小于或等于2.5 μm的颗粒物,PM2.5的值越大,则代表空气污染越严重
B.2018年22岁的中国科学家曹原发现将两层石墨烯以1.1 º的“魔角”旋转叠加在一起时可得到一种超导体。石墨烯是碳元素的一种同素异形体
C.顾名思义,苏打水就是苏打的水溶液,也叫弱碱性水,是带有弱碱性的饮料
D.工业上定期去除锅炉中的水垢,往往可以先加入Na2CO3溶液浸泡处理后,再加入盐酸去除沉淀物
难度: 简单查看答案及解析
-
化学是一门实验性的学科,下列有关化学实验的操作、预期现象和结论(或实验目的)均正确的是( )
选项
操作
预期现象
实验结论或目的
A
两支试管中先后分别加入2mL 0.1mol/LKI溶液和2mL 0.5mol/LH2SO4溶液及3滴淀粉溶液,再分别加入热水与冷水中
放入热水中的试管溶液先变蓝
探究温度对化学反应速率的影响
B
常温下,向浓硫酸中投入铝片
铝片不溶解
常温下,铝不与浓硫酸反应
C
向装有几片新鲜玫瑰花瓣的集气瓶中通入过量的干燥氯气
鲜花未褪色
Cl2没有漂白性
D
向某无色溶液中先加入过量盐酸,再加入氯化钡溶液
先无明显现象,后有白色沉淀生成
溶液中有SO42-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
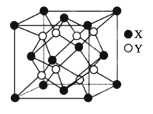
2019年是门捷列夫发现元素周期律150周年。A、B、C、D是原子序数依次增大的四种短周期主族元素;C离子半径是同周期元素中离子半径最小的;D的单质常作游泳池的消毒剂;常温下A的简单气态氢化物是元素周期表中所有元素的气态氢化物中最稳定的;B离子的核外电子排布与A离子相同。下列说法错误的是( )
A.A元素与D元素同主族,且其最高价氧化物的水化物的酸性A>D
B.B的最高价氧化物的水化物不一定能与C的最高价氧化物反应
C.原子半径大小:B>C>D>A
D.C与D形成的化合物的水溶液呈酸性
难度: 中等查看答案及解析
-
是一种重要的化工原料,下列有关说法错误的是( )
A.该物质的分子式为C7H8O
B.该物质属于芳香族化合物的同分异构体共有4种(不包括其本身)
C.该分子中所有碳原子共平面
D.1 mol该物质与足量的Na反应可产生11.2 L H2
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.检验FeCl3溶液中是否含有Fe2+,可向溶液中加入酸性高锰酸钾溶液,观察溶液是否褪色
B.己知:2CH2=CH2+O2
2
,该反应的反应类型为氧化反应
C.己知Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.1×10-10,所以碳酸钡的溶解度一定大于硫酸钡
D.用裂化汽油萃取溴水中的溴
难度: 中等查看答案及解析
-
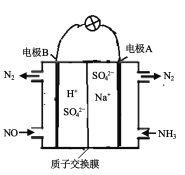
下列有关电化学的叙述,正确的是( )
A.
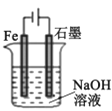 装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强B.
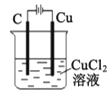 装置工作一段时间后碳极上有红色物质析出
装置工作一段时间后碳极上有红色物质析出C.
 装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑D.
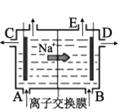 是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出难度: 简单查看答案及解析
-
室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
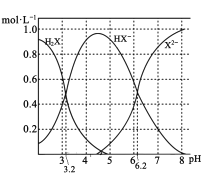
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
难度: 困难查看答案及解析
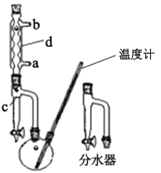 乙.
乙. 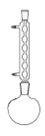 丙.
丙.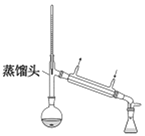
 )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成: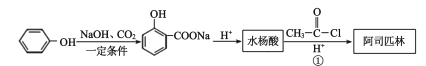
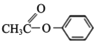 +HCl
+HCl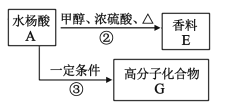
 的流程路线如下:
的流程路线如下: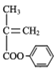 →
→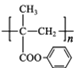 。请完善合成流程省略部分____。
。请完善合成流程省略部分____。