-
化学与生活密切相关,下列有关说法中正确的是
A.聚丙烯可使酸性高锰酸钾溶液褪色 B.福尔马林可用于食品的防腐保鲜
C.医用酒精可用于饮用水消毒 D.淀粉、油脂、蛋白质可提供营养
难度: 简单查看答案及解析
-
某有机物含C、H、O、N四种元素,其3D模型如图所示。下列有关该有机物的说法正确的是
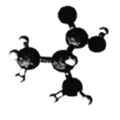
A.常温常压下呈气态 B.分子式为C3H7O2N
C.与甘氨酸互为同分异构体 D.分子中所有C、N原子均处于同一平面
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,4gD2O中含有的电子数为2NA
B.42gC2H4和C4H8的混合气中含有氢原子数为6NA
C.H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为
D.25℃时,1LpH=1的HCl溶液中含有的H原子数为0.1NA
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作和现象
预期实验目的或结论
A
向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
KI3溶液中存在平衡:I3-
I2+ I-
B
向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色
Ksp(AgCl)<Ksp(AgI)
C
室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH
比较HC1O和CH3COOH的酸性强弱
D
浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去
制得的气体为乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用电解尿素[CO(NH3)2]的碱性溶液制氢气的装置如图所示。下列说法错误的是
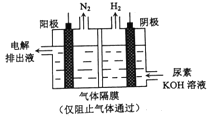
A. 为增强导电性,可用金属铜作阳极
B. 电解过程中阴、阳极产生的气体物质的量之比为3:1
C. 阴极的电极反应式为:2H2O+2e-=H2+2OH-
D. 阳极的电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2+6H2O
难度: 困难查看答案及解析
-
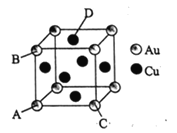
A、B、C、D均为短周期主族元素,原子序数依次增大,其原子的最外层电子数之和为18,A和C同主族,B原子的电子层数与最外层电子数相等,B、C、D的单质均可与NaOH溶液反应。下列说法正确的是
A.简单离子半径:D>B B.简单氢化物的热稳定性:C>A
C.AD4的熔沸点比CD4的高 D.可电解BD3溶液制备B的单质
难度: 中等查看答案及解析
-
常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的羟胺溶液, 羟胺的电离方程式为:NH2OH+H2O
NH3OH++OH-(25℃常温时, Kb=9.0×l0-9)。溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg3=0.5),下列分析正确的是
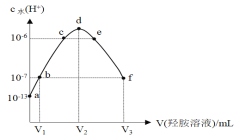
A.0.1 mol·L-1羟胺溶液的 pH=8.5 B.b点溶液中:c(H+) =c(OH-)
C.d点对应溶液中存在:c(H+)=c (OH-)+c (NH2OH) D.该稀盐酸的浓度为0.2 mol·L-1
难度: 困难查看答案及解析
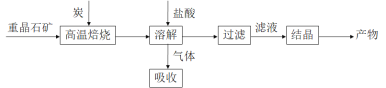
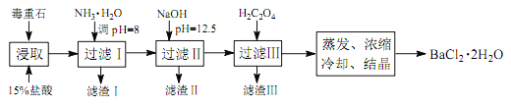
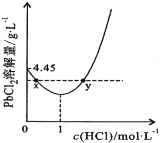

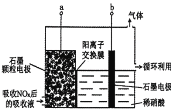

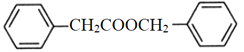 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。