-
针对下列实验现象表述错误的是
A.向二氧化硫水溶液中滴加氯化钡溶液,再通入适量氨气,产生BaSO3白色沉淀
B.将石蜡油蒸气分解得到的气体通入溴水中,溴水分层,上层为红棕色
C.向氯化铁和氯化亚铁溶液中滴加几滴K3[Fe(CN)6],生成蓝色沉淀
D.在表面皿中加入少量胆矾,再加入3mL浓硫酸,搅拌,固体由蓝色变为白色
难度: 中等查看答案及解析
-
自古以来,化学与人类生产、生活、科研密切相关,下列有关说法不正确的是( )
A.我国独创的世界首部可折叠柔屏手机通话时化学能转变成了电能
B.绿色化学的核心是利用化学原理解决食品安全的问题
C.制造新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
D.本草纲目记载:石胆出蒲州石穴中......涂于铁上,烧之红也。其中涉及了置换反应。
难度: 简单查看答案及解析
-
常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是
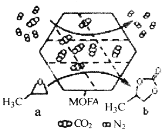
A.物质a分子中碳原子和氧原子均采取sp3杂化
B.b的一氯代物有3种
C.a生成b的反应类型为取代反应,并有极性共价键形成
D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放
难度: 中等查看答案及解析
-
下列实验操作、现象和结论都正确的是
选项
实验操作
现象
结论
A
向盛有硝酸的烧杯中加入铜粉
溶液上方产生红棕色气体
证明该硝酸为浓硝酸
B
取10mL 0.1mol/L FeCl3溶液,滴加10滴0.1mol/L KI溶液,继续加入2mL苯,振荡静置,取下层溶液,滴入AgNO3溶液
上层呈紫红色,下层溶液滴入AgNO3溶液生成白色沉淀
FeCl3与KI反应有一定的限度
C
向紫色石蕊试液中通入SO2
溶液褪色
SO2具有漂白性
D
在一块除去铁锈的铁片上面滴1滴含有酚酞的食盐水,静置2~3min
溶液边缘出现红色
铁片上发生了吸氧腐蚀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
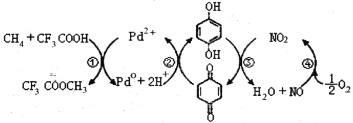
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2
2CH3OH
D.
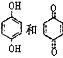 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同难度: 中等查看答案及解析
-
A~F均为中学化学常见的物质,它们之间存在如下转化关系,其中C和D的稀溶液不反应,B、C与D反应还可生成A(产物水等略去)。下列说法错误的是
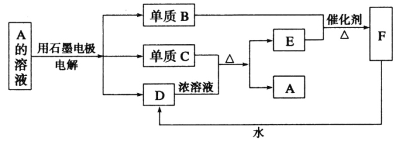
A.铂丝蘸取A溶液灼烧,焰色反应显蓝绿色
B.D的浓溶液有强氧化性
C.E是一种有毒气体,不能用作食品添加剂
D.A的溶液电解时,阳极反应式为4OH--4e-=2H2O+O2↑
难度: 中等查看答案及解析
-
五种短周期元素X、Y、Z、W、Q原子序数依次增大,W元素在短周期元素中原子半径最大,X、W同族,Z、Q同族,X、Y两种元素的最高正价和最低负价代数和均为0,由上述五种元素中的某几种元素组成的两种化合物均可在一定条件下洗涤含硫的试管,说法正确的是( )
A.X与Y形成的化合物只含有共价键
B.X与W形成的化合物中各原子均满足最外层8电子稳定结构
C.酸性:H2YO3<H2QO3,所以非金属性Y<Q
D.由Z、W、Q三种元素形成的盐只有两种
难度: 中等查看答案及解析
-
交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示,下列判断正确的是
CrO3固体
K2CrO4溶液
K2Cr2O7溶液
CrO2Cl2+COCl2
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
难度: 中等查看答案及解析
-
下列关于各实验装置的叙述错误的是
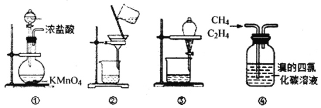
A.装置①可用于实验室制取氯气
B.装置②可用于洗涤BaSO4表面的Na2SO4
C.装置③可用于分离乙酸乙酯和饱和碳酸钠溶液的混合物
D.装置④可用于除去甲烷中的乙烯气体
难度: 中等查看答案及解析
-
将浓度均为0.5mol·L-1的氨水和KOH溶液分别滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是
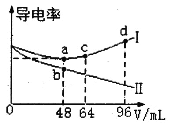
A.c1=0.2
B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac段发生的反应为:A1(OH)3+OH-==[Al(OH)4]-
D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
难度: 困难查看答案及解析
-
一种水基二次电池原理为
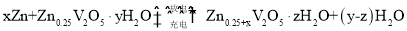 ,电解液为含Zn2+的水溶液,该电池可用于电网贮能。
,电解液为含Zn2+的水溶液,该电池可用于电网贮能。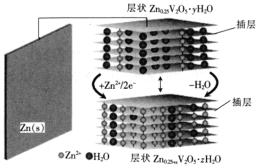
下列说法正确的是( )
A. 放电时,Zn2+脱离插层
B. 放电时,溶液中Zn2+浓度一直减小
C. 充电时,电子由
层经电解质溶液流向
层
D. 充电时,阳极发生电极反应:
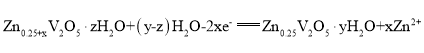
难度: 中等查看答案及解析
-
用
与
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
;③打开K,通入
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
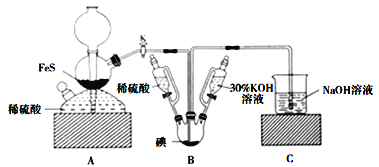
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为
C.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
D.装置C中氢氧化钠溶液的作用是吸收硫化氢
难度: 困难查看答案及解析
-
在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
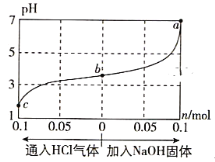
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数
难度: 中等查看答案及解析
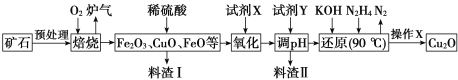
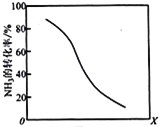




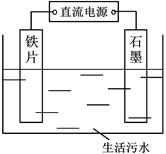
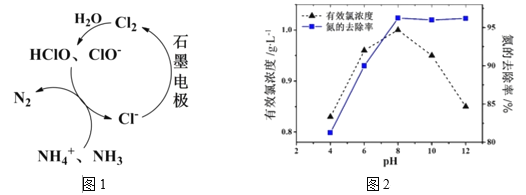
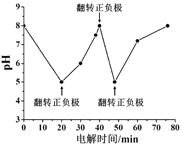
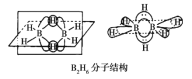
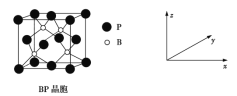
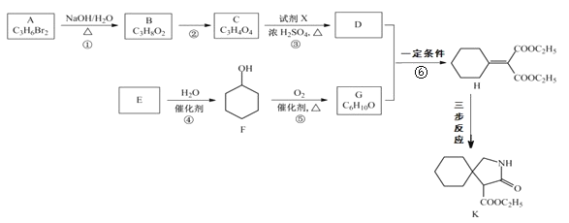
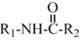 +C2H5OH
+C2H5OH