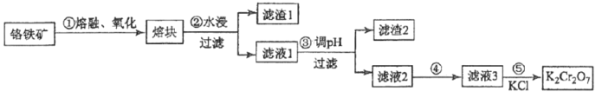
-
下列颜色变化与氧化还原反应无关的是( )
A. 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B. 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去
C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去
D. 将新制氯水滴入紫色石蕊溶液中,溶液先变红色后褪色
难度: 中等查看答案及解析
-
硅及其化合物在材料领域中应用广泛。下列叙述不正确的是 ( )
选项
物质
用途
原理
A
晶体硅
电脑芯片
熔点高、硬度大
B
二氧化硅
光导纤维
透明无色固体
C
硅酸钠
玻璃粘合剂
浓度高时是一种粘稠液体
D
硅胶
吸水剂
具有疏松多孔的结构
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于金属铝及氧化铝说法不正确的是( )
A.铝合金具有密度小、高强度及较好的可塑性,可用于制飞机骨架等。
B.铝在自然界中有游离态和化合态两种形式
C.由于表面存在致密的氧化铝,因此金属铝在空气中有良好的抗腐蚀性。
D.氧化铝是一种高硬度、高熔沸点的化合物,红宝石、蓝宝石的主要成分是氧化铝。
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.金属元素在不同的化合物中化合价均相同
B.所有合金都只含有金属元素
C.可利用铝热反应冶炼单质镁
D.电解熔融氯化钠可以制得金属钠
难度: 简单查看答案及解析
-
某溶液能与铝作用生成氢气,则溶液中一定大量共存的离子组是( )
A.Na+、Ba2+、Mg2+、Cl-
B.Cl-、HCO3-、Ca2+、K+
C.NO3-、SO42-、K+、Fe2+
D.Na+、Ba2+、Cl-、Br-
难度: 简单查看答案及解析
-
已知:①Co2O3在酸性溶液中易被还原成Co2+;②氧化性Co2O3>Cl2>Fe3+>I2,下列反应在水溶液中不可能发生的是( )
A.2Fe3++2I-=2Fe2++I2
B.Cl2+2Fe2+=2Fe3++2Cl-
C.Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O
D.3Cl2+6FeI2=2FeCl3+4FeI3
难度: 简单查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
A.向澄清石灰水中通入过量的CO2
B.向Na[Al(OH)4]溶液中逐滴加入过量的稀盐酸
C.向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液
D.向硅酸钠溶液中逐滴加入过量的盐酸
难度: 简单查看答案及解析
-
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-等六种微粒,其中N2的物质的量随时变化曲线如图所示,下列判断正确的是( )
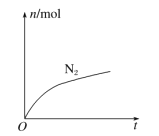
A.该反应的氯元素被氧化
B.反应后溶液的酸性明显减弱
C.消耗1 mol还原剂,转移3 mol电子
D.氧化剂与还原剂的物质的量之比为2∶3
难度: 中等查看答案及解析
-
用铝热法还原下列化合物,1mol化合物完全反应,需消耗铝单质最多的是( )
A.MnO2 B.WO3 C.Co3O4 D.Cr2O3
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A.
(A-N+m)mol B.
(A-N)mol C.
(A-N)mol D.
(A-N+m)mol
难度: 简单查看答案及解析
-
向500~600℃的铁屑中通入氯气生产无水氯化铁,现用如图所示的装置进行实验,下列说法正确的是

A.分液漏斗中盛放的试剂是稀盐酸
B.洗气瓶中盛放的试剂是饱和食盐水
C.应先点燃I中酒精灯,再点燃III中酒精灯
D.烧杯中盛放石灰水,目的是吸收尾气
难度: 中等查看答案及解析
-
四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
A.若X单质即可与强酸,也可与强碱溶液反应,则M单质可做半导体
B.若M、Z、Y皆存在简单阴离子,则离子半径:M>Z>Y
C.若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
D.若四种元素的原子序数之和为56,则Z的单质可以用作自来水的消毒剂
难度: 中等查看答案及解析
-
某无色溶液可能含有Cl-、SO42-、CO32-、Fe3+、Ba2+和K+。
(1)取该溶液中加足量BaCl2溶液,得到白色沉淀X,过滤。
(2)取白色沉淀X加入足量盐酸,产生气泡,但仍有部分沉淀残留。
(3)取(1)中滤液,加入足量硝酸银与稀硝酸,得到白色沉淀
由此可知原溶液中 ( )
A.至少有4种离子
B.Cl-一定存在
C.SO42-、CO32-一定存在,Cl-可能不存在
D.Fe3+、Ba2+一定不存在,K+可能存在
难度: 中等查看答案及解析
-
铝土矿主要成分是氧化铝、氧化铁、二氧化硅等。从铝土矿中提炼氧化铝的流程如下:

下列说法正确的是( )
A.“滤渣”的成分是氢氧化铁
B.“沉淀”的成分是二氧化硅
C.“气体A”是足量的氨气
D.整个流程中铝元素的化合价没有发生改变
难度: 中等查看答案及解析