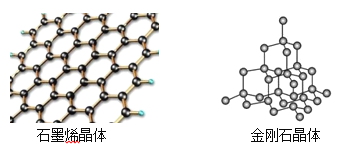
-
下列实验操作不当的是
A. 用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B. 用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D. 常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
难度: 中等查看答案及解析
-
我国科技创新成果斐然,下列成果中以制备非金属单质为主要目的的是( ) 。
A.
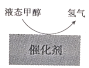 低温制备H2
低温制备H2B.
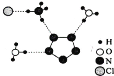 合成全氮阴离子盐(N5)6(H3O)3(NH4)4Cl
合成全氮阴离子盐(N5)6(H3O)3(NH4)4ClC.
 成功开采可燃冰(CH4·nH2O)
成功开采可燃冰(CH4·nH2O)D.
 研制出超高强钢
研制出超高强钢难度: 简单查看答案及解析
-
下列变化中,未涉及到电子转移的是( ) 。
A.H2C2O4使酸性KMnO4溶液褪色
B.C2H5OH使酸性K2Cr2O7溶液变绿
C.CO2使苯酚钠溶液变浑浊
D.Na2O2放置空气中变白
难度: 简单查看答案及解析
-
2020年的春节期间,新冠病毒肆虐。因为核酸是生命的基础物质,是病毒的“身份证”,所以患者的确诊需要病毒的核酸检验。以下关于核酸的论述正确的是 ( )。
A.核酸是核蛋白的非蛋白部分,也是由氨基酸残基组成的
B.核酸水解产物中含有磷酸、葡萄糖和碱基
C.核酸、核苷酸都是高分子化合物
D.核酸有核糖核酸和脱氧核糖核酸两类,对蛋白质的合成和生物遗传起重要作用
难度: 简单查看答案及解析
-
实现下列变化时,需要克服相同类型作用力的是
A.水晶和干冰的熔化 B.食盐和醋酸钠的熔化
C.液溴和液汞的汽化 D.HCl和NaCl溶于水
难度: 简单查看答案及解析
-
下列正确的是( )。
A.碱性:Al(OH)3>NaOH
B.原子半径:Cl>S
C.第一电离能:Mg>Al
D.沸点:H2S>H2O
难度: 简单查看答案及解析
-
邻甲基苯甲酸主要用于农药、医药及有机化工原料的合成,其结构简式为
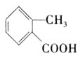 ,下列关于该物质的说法正确的是( )。
,下列关于该物质的说法正确的是( )。A.该物质能与溴水生成白色沉淀
B.该物质含苯环的同分异构体中能水解且含有甲基的共5种
C.1mol该物质最多能与4molH2生加成反应
D.该物质中所有原子共平面
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为( )。
A.向FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.向碳酸钠溶液中通入少量CO2:CO32-+2CO2+H2O=2HCO3-
C.向碘化钾溶液中加入少量双氧水:3H2O2+I-=IO3-+3H2O
D.向CuSO4溶液中通入H2S:H2S+Cu2+=CuS↓+2H+
难度: 简单查看答案及解析
-
已知CH4-CO2催化重整反应为:CH4(g)+CO2(g)
2CO(g)+2H2(g) ΔH=+247kJ·mol−1,则有利于提高CH4平衡转化率的条件是( )
A.高温低压 B.低温高压 C.高温高压 D.低温低压
难度: 简单查看答案及解析
-
我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如下:
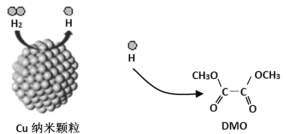
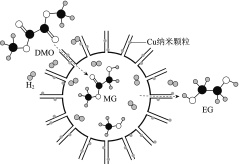
下列说法不正确的是( )。
A.Cu纳米颗粒将氢气解离成氢原子
B.反应过程中生成了MG和甲醇
C.DMO分子中只有碳氧单键发生了断裂
D.EG和甲醇不是同系物
难度: 中等查看答案及解析
-
用电渗析法处理含Na2SO4废水,原理如图所示,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子不能进入中间隔室。
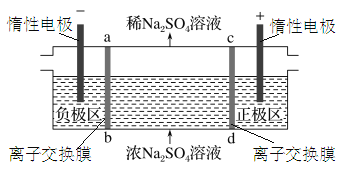
下列叙述正确的是( )。
A.当电路中通过2 mol电子的电量时,会有2mol的H2生成
B.负极区得到NaOH,正极区得到H2SO4
C.负极反应为2H2O-4e-=O2+4H+,负极区溶液pH增大
D.通电后中间隔室的SO42-离子向负极迁移,正极区溶液pH降低
难度: 简单查看答案及解析
-
T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。

A.a~b~d为滴定ZnCl2溶液的曲线
B.对应溶液pH:a<b<e
C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)]
D.d点纵坐标约为33.9
难度: 中等查看答案及解析