-
升高温度,下列物理量的值一定增大的是( )
A.化学反应的焓变 B.化学平衡常数 C.反应物的转化率 D.弱酸的电离平衡常数
难度: 中等查看答案及解析
-
具有解热、镇痛等作用的药物“芬必得”主要成分的结构简式为
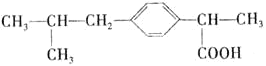 ,该物质属于( )
,该物质属于( )①芳香化合物 ②脂环化合物 ③羧酸 ④有机高分子化合物 ⑤芳香烃
A.③⑤ B.②③ C.①④ D.①③
难度: 简单查看答案及解析
-
关于中和热测定实验的下列说法不正确的是( )
A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B.向盛装酸的烧杯中加碱时要小心缓慢
C.使用环形玻璃棒既可以搅拌又避免损坏温度计
D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度
难度: 简单查看答案及解析
-
反应A2+3B2 =2AB3在2L的密闭容器中进行,5s后,A2的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A.v (A2)=0.01 mol/(L·s) B.v (B2)=0.08 mol/(L·s)
C.v (AB3)=0.03 mol/(L·s ) D.v (AB3)=0.06 mol/(L·s )
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 简单查看答案及解析
-
下列有关说法不正确的是
A.同一物质的固、液、气三种状态的熵值相同
B.自发进行的化学反应的方向,应由焓判据和熵判据的复合判据来判断
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
难度: 简单查看答案及解析
-
用水稀释1mol/L氨水时,溶液中随着水量的增加而增加的是
A.c(H+)和c(OH-)的乘积 B.
C.OH-的物质的量浓度 D.H+的物质的量浓度
难度: 中等查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极被氧化 B.溶液的pH不断减小
C.SO42-只向PbO2处移动 D.电子由Pb极流向PbO2极
难度: 简单查看答案及解析
-
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7 B.2.0 C.12.0 D.12.4
难度: 简单查看答案及解析
-
工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2++MnS=CuS+Mn2+,下列说法错误的是( )
A.该反应达平衡时c(Mn2+)=c(Cu2+)
B.MnS的Ksp比CuS的Ksp大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法,正确的是( )
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重

B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
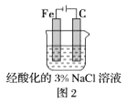
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀

D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
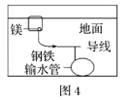
难度: 简单查看答案及解析
-
下图是电解饱和 NaCl 溶液的实验装置,x、y 都是惰性电极,a 是饱和 NaCl 溶液,同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是
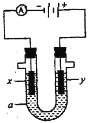
A.x 电极为阳极,y 电极为阴极
B.x 电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1
D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
分子式为C5H10,且含有甲基和碳碳双键的有机物共有(不考虑顺反异构)( )
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
工业上燃烧硫矿石制取硫酸产生的废气SO2,用电化学原理将SO2转化为重要的化工原料,如图,下列说法正确的是( )
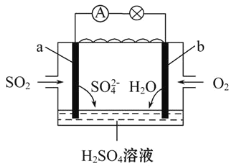
A.电池工作时,消耗O2、SO2物质的量之比为2∶1
B.电子从a极经导线移向b极,再经溶液移向a极
C.电池工作一段时间后电解质溶液的pH增大
D.a为负极,电极反应式为SO2+2H2O-2e-= SO42-+4H+
难度: 中等查看答案及解析
-
下列事实不能证明HNO2是弱电解质的是( )
①滴入酚酞,NaNO2溶液显红色②用HNO2溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强
④0.1mol•L-1HNO2溶液的pH=2⑤HNO2与CaCO3反应放出CO2气体
⑥c(H+)=0.1mol•L-1的HNO3溶液稀释至1000倍,pH<4
A.②⑤ B.①⑤ C.③⑥ D.③④
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
 已知:碳的燃烧热
已知:碳的燃烧热
则x为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
的一溴代物和
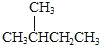 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物
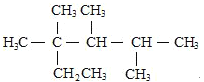 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷D.
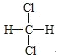 与
与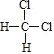 互为同分异构体
互为同分异构体难度: 简单查看答案及解析
-
有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是
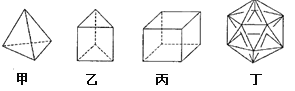
A.1mol甲分子内含有10mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.分子丁显然是不可能合成的
难度: 中等查看答案及解析
-
下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()
A.
 B.
B. C.
C. D.
D.
难度: 中等查看答案及解析

