-
下列说法不正确的是
A. 电解熔融氯化镁可制取金属镁
B. 电解饱和食盐水可制取氯气
C. 生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D. 接触法制硫酸的硫元素主要来源于硫黄或含硫矿石
难度: 中等查看答案及解析
-
已知如下两个热化学方程式:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol ,2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol。现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是( )
A.1:1 B.l:2 C.2:3 D.3:2
难度: 中等查看答案及解析
-
下列说法正确的是
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
难度: 中等查看答案及解析
-
下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应
难度: 简单查看答案及解析
-
下列物质中属于电解质的是( )
①氯化钠 ②NH3•H2O ③铜 ④蔗糖 ⑤二氧化碳
A.①② B.④⑤ C.③④ D.①⑤
难度: 简单查看答案及解析
-
下列仪器中,使用时必须检查是否漏水的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
我国科学家最近发现一种只有六个中子构成的粒子,这种粒子称为“六中子”,也有人称之为“零号元素”。下列有关“六中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为6
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子的大
难度: 简单查看答案及解析
-
下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是
A. 前者是混合物,后者是纯净物 B. 两者都具有丁达尔效应
C. 分散质的粒子直径均在1~100nm之间 D. 前者可用于杀菌,后者可用于净水
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A.CH4的球棍模型:
 B.N2的电子式:N:::N
B.N2的电子式:N:::NC.S2-的结构示意图:
D.二氧化碳的结构式:O=C=O
难度: 简单查看答案及解析
-
下列关于物质性质的比较,不正确的是
A.酸性强弱:HIO4>HBrO4> HClO4 B.原子半径大小:Na> S >O
C.热稳定性:HCl>H2S>PH3>AsH3 D.碱性强弱:KOH > NaOH > LiOH
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.核素
H的中子数是2
B.12C和14C互为同位素
C.金刚石、石墨和富勒烯互为同素异形体
D.CH3CH2OH和CH3OCH3互为同分异构体
难度: 简单查看答案及解析
-
下列物质中,能通过单质直接化合制得的是( )
A.Fe(OH)3 B.FeCl2 C.FeCl3 D.CuS
难度: 简单查看答案及解析
-
四种短周期元素X、Y、Z和M在周期表中的位置如图所示。下列说法正确的是( )
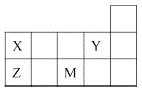
A.原子半径(r):r(X)>r(Z)
B.元素的非金属性:Y>M
C.Y元素的最高化合价为+7价
D.Z的最高价氧化物的水化物为强酸
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.少量的二氧化碳气体通入足量烧碱溶液中反应CO2+OH-=HCO3-
C.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向碳酸钙中滴加醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
X(g)+3Y(g)
2Z(g) ΔH=-akJ·mol-1,一定条件下将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是( )
A.10min内,Y的平均反应速率为0.03mol·L-1·s-1
B.第10min时,X的反应速率为0.01mol·L-1·min-1
C.10min内,消耗0.2molX,生成0.2molZ
D.10min内,X和Y反应放出的热量为0.2akJ
难度: 中等查看答案及解析
-
把下列四种碳酸氢钠溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时碳酸氢钠和盐酸反应,其中反应开始时速率最大的是
A.10 ℃ 20 mL 3 mol·L-1的碳酸氢钠溶液
B.20 ℃ 30 mL 2 mol·L-1的碳酸氢钠溶液
C.20 ℃ 10 mL 4 mol·L-1的碳酸氢钠溶液
D.10 ℃ 20 mL 2 mol·L-1的碳酸氢钠溶液
难度: 极难查看答案及解析
-
可逆反应:2NO2
2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(6) B.(2)(3)(5)
C.(1)(3)(4) D.(1)(2)(3)(4)(5)(6)
难度: 中等查看答案及解析
-
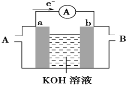
2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,
与
在多孔碳材料电极处生成
(
或1)。下列说法正确的是

A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.一定条件下,1molFe与1molCl2充分反应,Fe失去的电子数目为3NA
B.在常温常压下,11.2L氯气含有分子数为0.5NA
C.7.8gNa2O2与水完全反应时,转移的电子数为0.1NA
D.1.2gNaHSO4晶体中所含离子数为0.03NA
难度: 简单查看答案及解析
-
下列现象不能用氢键解释的是( )
A.冰的密度小于液态水 B.氨易液化
C.HF的沸点高于HI D.HCl比HI分子更稳定
难度: 简单查看答案及解析
-
已知断开1molCl2(g)中的化学键需要吸收242.7kJ的能量。根据反应H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法不正确的是( )
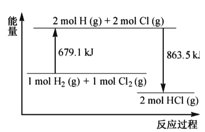
A.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.4kJ·mol-1
B.HCl(g)=
H2(g)+
Cl2(g) ΔH=92.2kJ·mol-1
C.断开1molH2(g)中的化学键需要吸收436.4kJ的能量
D.H2(g)和Cl2(g)形成1molHCl(g)释放863.5kJ的能量
难度: 简单查看答案及解析
-
下列实验方案不能达到实验目的的是
编号
实验目的
实验方案
A
探究催化剂对
分解速率的影响
两支试管中均盛有
溶液,向其中一支试管中加入少量
,比较实验现象
B
探究
的还原性
向盛有
水溶液的试管中滴加
溶液,再滴加新制氯水,振荡,放置片刻后滴加稀盐酸
C
比较
和
的金属性强弱
两支试管中分别放入已除去氧化膜、大小相同的镁条和铝条,再各加入
盐酸,比较实验现象
D
制取并纯化氢气
向稀盐酸中加入纯锌粒,将生成的气体依次通过浓硫酸、
溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将过量的两份锌粉a、b分别加入等体积等浓度的两份稀硫酸中,同时向a中加少量CuSO4溶液,图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A.
 B.
B.C.
D.

难度: 简单查看答案及解析
-
以硫酸工业的SO2尾气、氨水、石灰石、焦炭等为原料,可以得到有重要应用价值的CaS、(NH4)2SO3等物质,流程如图:

下列说法不正确的是( )
A.反应Ⅰ的化学方程式为:2CaCO3+2SO2+O2=2CaSO4+2CO2
B.生产中反应Ⅰ中需鼓入足量空气以保证SO2充分氧化生成CaSO4;向反应Ⅱ溶液中加入适量还原性的物质,其目的是防止(NH4)2SO3被氧化
C.将反应Ⅱ后的溶液加热到有较多固体析出,再用余热将液体蒸干,可得(NH4)2SO3·H2O
D.反应Ⅲ中氧化剂与还原剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
某澄清透明的溶液中可能含有:Na+、Mg2+、Fe2+、Cu2+、I-、CO32-、SO42-、Cl-中的几种,各离子浓度均为0.1mol/L,现进行如图实验(所加试剂均过量):
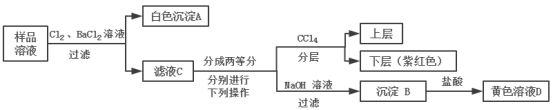
下列说法正确的是( )
A.样品溶液中肯定存在Na+、Fe2+、SO42-
B.沉淀B中肯定有氢氧化铁,可能含有氢氧化镁
C.取1L黄色溶液D,能恰好溶解铁1.4g
D.该样品溶液中是否存在Cl-可取滤液C,滴加硝酸银和稀硝酸进行确定
难度: 中等查看答案及解析