-
化学与生产生活、环境保护等密切相关。下列做法不正确的是
A. 推广使用电动汽车低碳交通工具
B. 用CO2合成可降解的聚碳酸酯塑料
C. 用生物方法脱除生活污水中的氮和磷
D. 加大铅酸蓄电池、含汞锌锰等电池的生产
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
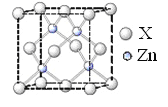
A. 甲烷分子的球棍模型:
B. NH4Br的电子式:
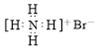
C. 34S2-的结构示意图:
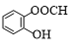
D. 邻羟基苯甲酸的结构简式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. 常温下铁能被浓硝酸钝化,可用铁制容器贮运浓硝酸
B. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C. 浓硫酸有吸水性,可用于干燥二氧化硫和氨气
D. 金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 L苯中所含C-H键数目为3NA
B. 7.8g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA
C. 1 mol Cl2发生反应时,转移的电子数一定为2NA
D. 常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA
难度: 中等查看答案及解析
-
五种短周期元素X、Y、Z、W、M的原子序数依次增大,元素X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,M的最高正价与最低负价的绝对值之差为4,五种元素原子的最外层电子数之和为19。下列说法正确的是
A. W的最高价氧化物能与水反应生成相应的酸
B. 工业上常用单质X还原Z的氧化物制取单质Z
C. 简单离子半径由大到小的顺序:Y>Z>M
D. 化合物 YX2中既含有离子键,也含有共价键
难度: 中等查看答案及解析
-
下列指定化学反应的离子方程式正确的是
A. 二氧化锰和浓盐酸共热: MnO2 +4HCl
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加过量的浓氨水:Al3++4NH3·H2O=AlO
+4NH4++2H2O
C. 将Cu2O与稀HNO3混合:3Cu2O+14H++2NO
===6Cu2++2NO↑+7H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,所得结论不正确的是
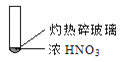
①
②
③
A. 实验①②③产生的气体中都含有NO2气体
B. 实验①表明浓硝酸具有受热易分解的性质
C. 实验②不能表明红热木炭与浓硝酸发生了反应
D. 实验③的气体产物中不可能含有二氧化碳气体
难度: 中等查看答案及解析
-
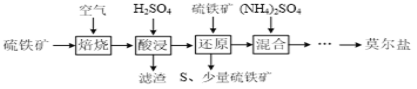
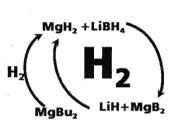
重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO•Cr2O3、SiO2等)制备,制备流程如图所示:

已知:a.步骤①的主要反应为: 2FeO•Cr2O3+4Na2CO3+ 7NaNO3
4Na2CrO4+Fe2O3+4CO2+7NaNO2 b. 2CrO42-+2H+
Cr2O72-+H2O
下列说法正确的是
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8L(标况下) CO2共转移14mol电子
C. 步骤④若调节滤液2的pH使之变大,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7溶解度小于Na2Cr2O7
难度: 中等查看答案及解析
-
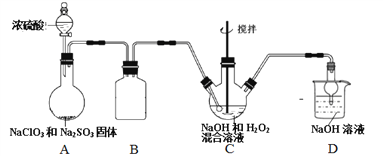
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
用乙醇与浓硫酸反应制乙烯,将产生的气体直接通入酸性高锰酸钾溶液中
高锰酸钾溶液的紫红色褪去
证明乙烯能被酸性高锰酸钾氧化
B
测定等浓度的Na2CO3和Na2SO3的溶液的pH
前者pH比后者大
证明非金属性:S>C
C
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置
下层液体呈紫红色
证明氧化性: Br2>I2
D
向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液
品红溶液褪色
该钠盐为Na2SO3或NaHSO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
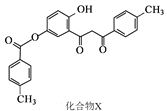
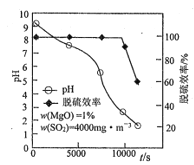
 (即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是
(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是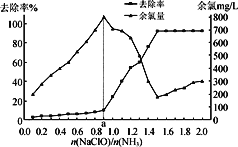
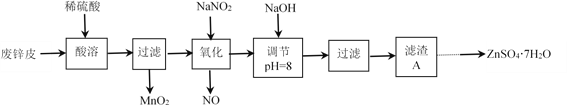
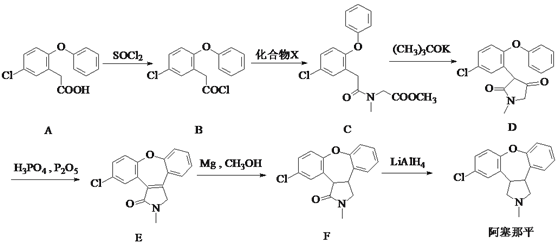
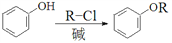 ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、 CH3NH2和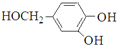 为原料制备
为原料制备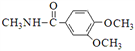 的合成路线流程图(无机试剂任用) _______。合成路线流程图示例如:
的合成路线流程图(无机试剂任用) _______。合成路线流程图示例如: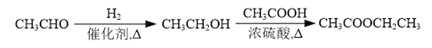

 +H2O
+H2O