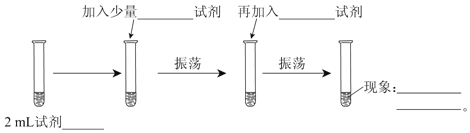
-
下列说法不正确的是( )
A. 太阳能电池可用硅材料制作,其应用有利于环保、节能
B. SiO2可用于制造光导纤维
C. Na2SiO3水溶液俗称水玻璃,可用作木材防火剂及黏胶剂
D. 建设三峡大坝使用了大量水泥,水泥是有机材料
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.在周期表中,族序数都等于该族元素的最外层电子数
B.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强
C.卤素单质随原子序数的增大,其熔沸点逐渐降低
D.碱金属随原子序数的增大,其熔沸点逐渐降低
难度: 简单查看答案及解析
-
关于原子结构的叙述正确的是
A.所有的原子核都是由质子和中子组成的 B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8 D.原子的次外层电子数都是2
难度: 简单查看答案及解析
-
电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是
A.CO和CO2 B.NO和NO2 C.CH4和NH3 D.CO2和SO2
难度: 简单查看答案及解析
-
在RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A.A-x+n+48 B.A-x+n+24 C.A-x-n-24 D.A+x-n-24
难度: 简单查看答案及解析
-
简单原子的原子结构可用下图来形象表示:
①
②
③
其中·表示质子或电子,°表示中子,则下列有关的叙述中,正确的是( )
A. ①②③为同素异形体 B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子 D. ①②③具有相同的质量数
难度: 中等查看答案及解析
-
下列化合物中,既有离子键,又有共价键的是( )
A.H2O B.CaCl2 C.KOH D.NH3
难度: 中等查看答案及解析
-
随着核电荷数的递增,氧化性逐渐减弱的一组是( )
A.I2、Br2、Cl2、F2 B.F2、Cl2、Br2、I2 C.F-、Cl-、Br-、I- D.Li、Na、K、Rb
难度: 简单查看答案及解析
-
下列元素中,原子半径最大的是
A.Li B.Na C.F D.Cl
难度: 简单查看答案及解析
-
下列有关化学用语表达不正确的是( )
A. 氮气的电子式:∶N∶∶∶N∶ B. CO2分子的结构式:O=C=O
C. Na的原子结构示意图:
D. 钙离子的电子式:Ca2+
难度: 简单查看答案及解析
-
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
难度: 中等查看答案及解析
-
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )
A.元素X:它的原子中M层比L层少2个电子
B.元素Y:它的二价阳离子核外电子总数与氩原子相同
C.元素Z:位于元素周期表中的第三周期,ⅢA族
D.元素W:它的焰色反应颜色呈黄色
难度: 中等查看答案及解析
-
下列装置能构成原电池的是( )
A.
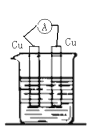 B.
B.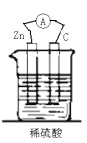
C.
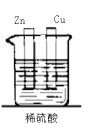 D.
D.
难度: 简单查看答案及解析
-
在N2+3H2
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol/L,在此时间内用NH3表示的反应速率为0.30 mol/(L·s)。则此一段时间是
A.1秒 B.2秒 C.0.44秒 D.1.33秒
难度: 简单查看答案及解析
-
A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B与稀硫酸组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B C.C>B>A D.B>C>A
难度: 简单查看答案及解析
-
已知可逆反应2SO2+O2
2SO3是放热反应,下列说法正确的是( )
A.2 molSO2与1molO2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率
B.2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率
C.2mol SO2与1 molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
D.2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率
难度: 简单查看答案及解析
-
据报道,氢燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是
A. 电解水制取氢气是理想而经济的制氢方法
B. 发展氢燃料电池汽车不需要安全高效的储氢技术
C. 氢燃料电池汽车的使用可以有效减少城市空气污染
D. 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
难度: 中等查看答案及解析
-
根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是( )
A.固体氯化钠溶于水 B.氯化铵受热分解生成氯化氢和氨气
C.冰经加热变成水蒸气 D.氯化氢溶于水
难度: 中等查看答案及解析
-
关于金属钾的叙述中,错误的是( )。
A. 与水反应时,比钠还剧烈 B. 它的原子半径比钠的原子半径小
C. 密度比钠小 D. 它可以作还原剂
难度: 中等查看答案及解析
-
人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的 B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量 D.化学反应前后反应物和生成物所含能量会发生变化
难度: 简单查看答案及解析
-
对于可逆反应:M+N
Q达到平衡时,下列说法正确的是( )
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应中混合物各成分的百分组成不再变化
D.反应已经停止
难度: 中等查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸与氢氧化钠溶液反应 B.氯化氢溶于水
C.氯化氢与氨气反应生成氯化铵固体 D.锌与稀硫酸反应
难度: 中等查看答案及解析