-
短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L 戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。下列说法不正确的是( )
A. 原子半径:Z>W>Y>X
B. Z分别与X、Y、W形成的化合物中一定没有共价键
C. 元素Y与X、Z都能组成两种化合物
D. 乙与戊的水溶液反应后所得溶液具有漂白性
难度: 困难查看答案及解析
-
下列实验过程可以达到实验目的的是( )
编号
实验过程
实验目的
A
称取2 g CuSO4•5H2O溶于98g水中,充分搅拌溶解,然后装入试剂瓶中
配制2%的CuSO4溶液
B
将活性炭放入盛有NO2的锥形瓶中,观察气体颜色
探究碳的还原性
C
将ZnSO4溶液滴入盛有2mLNa2S溶液的试管中至不再产生沉淀,然后滴入相同浓度的CuSO4溶液,观察现象
比较ZnS(白色)和CuS(黑色)的溶度积
D
向两支试管中分别加入2mL5%H2O2溶液然后只向其中一支试管中加入绿豆大小的FeI2固体,观察比较现象
探究I-对H2O2分解是否具有催化作用
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18 NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0 NA
D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0 NA
难度: 简单查看答案及解析
-
五年来,我国在探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等领域取得了举世瞩目的成就。这些项目与化学有着密切联系。下列说法正确的是( )
A.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
B.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
难度: 简单查看答案及解析
-
1,1-二环丙基乙烯(
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子可能在同一平面 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有9种 D. 生成1mol C8H18至少需要3mol H2
难度: 中等查看答案及解析
-
我国科学家开发的一种“磷酸钒锂/石墨离子电池”在4.6V电位区电池总反应为:Li3C6+V2(PO4)3
6C+Li3V2(PO4)3。下列有关说法正确的是

A.该电池比能量高,用Li3V2(PO4)3做负极材料
B.放电时,外电路中通过0.1 mol电子M极质量减少0.7 g
C.充电时,Li+向N极区迁移
D.充电时,N极反应为V2(PO4)3+3Li++3e-=Li3V2(PO4)3
难度: 中等查看答案及解析
-
25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示
 ,下列叙述错误的是
,下列叙述错误的是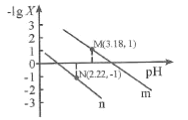
A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
难度: 困难查看答案及解析
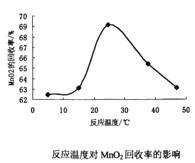
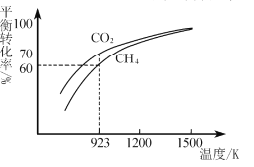
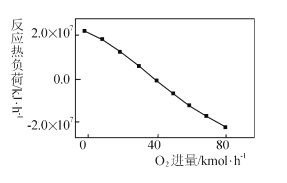
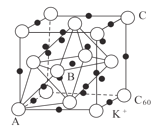
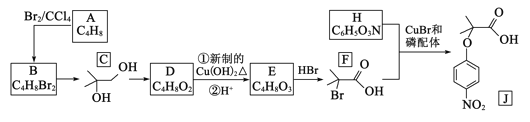
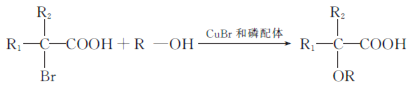
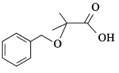 的合成路线:__________________。
的合成路线:__________________。