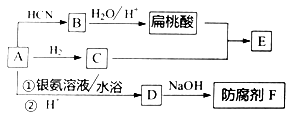
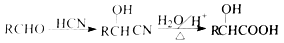-
下列说法正确的是
A. CO2的电子式为
B. 浓H2SO4试剂瓶上应贴上危险警告标签
C. 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液
D. 核内含8个中子的碳原子可表示为86C
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法中正确的是
A. 22.4LNH3分子中含有3NA个N—H键
B. 2.3 g Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA
C. 1 L0.1 mol·L-1蔗糖溶液中所含分子数为0.1NA
D. 常温常压下,46g NO2含有的原子数小于3NA
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+= Cu2++2Fe2+
B. Na2O2 与H2O反应制备O2:Na2O2+H2O = 2Na++ 2OH-+O2↑
C. 硫化钠水溶液呈碱性的原因:S2-+2H2O
H2S↑+2OH-
D. 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑
难度: 中等查看答案及解析
-
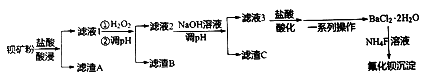
用下图装置制备、净化、收集下表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
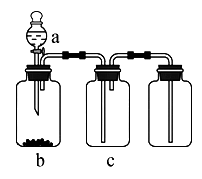
选项
气体
a
b
c
A
NO2
浓硝酸
铜片
NaOH溶液
B
H2
稀硫酸
锌片
浓硫酸
C
NH3
浓氨水
生石灰
碱石灰
D
O2
双氧水
MnO2粉末
浓硫酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
M是中药狼把草的成分之一,具有消炎杀菌作用,其结构如图所示。下列叙述正确的是
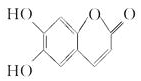
A. M的分子式为C9H10O4
B. M与浓溴水既能发生取代反应,又能发生加成反应
C. —定条件下,1 mol M最多能与3molH2发生反应
D. M能分别与Na、NaOH、NaHCO3发生反应
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,X是周期表中原子半径最小的元素,Y的最高正价与最低负价绝对值相等,W最外层电子数是最内层电子数的3倍,R是同周期元素中原子半径最小的元素。下列说法不正确的是
A. 原子半径Z>W>R
B. 对应的氢化物的热稳定性:R>W>Y
C. 单质Z可与R的最高价含氧酸发生置换反应
D. W与R所形成的简单离子均能影响水的电离平衡
难度: 困难查看答案及解析
-
某温度下,向一定体积0.1 mol·L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示。 下列说法错误的是
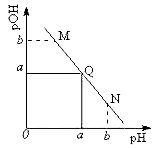
A. 此温度下,水的离子积常数为1.0×10-2a
B. M、N两点所示的溶液中,水的电离程度相同
C. Q点消耗的NaOH溶液的体积等于HA溶液的体积
D. N点溶液加水稀释,
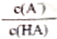 减小
减小难度: 困难查看答案及解析