-
a、b、c、d、e、f、g是短周期中原子序数依次递增的主族元素,a、b元素最高正价与最低负价之和均为O、d、f是同主族元素,f元素原子序数是d元素原子序数的2倍,e元素原子半径是短周期中最大的。下列说法错误的是( )
A.e与a形成的化合物熔沸点高于e与g形成的的化合物
B.b的氧化物的水化物酸性弱于g的氧化物的水化物酸性
C.b、c、d与a均可形成含非极性键的二元化合物
D.d与e、f、g均可形成有漂白性的二元化合物
难度: 简单查看答案及解析
-
室温下,下列各组微粒在指定溶液中能大量共存的是
A.pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42-
B.c(Ca2+)=0.1mol·L-1的溶液中:NH4+、C2O42-、Cl-、Br-
C.含大量HCO3-的溶液中:C6H5O-、CO32-、Br-、K+
D.能使甲基橙变为橙色的溶液:Na+、NH4+、CO32-、Cl-
难度: 中等查看答案及解析
-
《本草纲目》中“石碱”一条记载:石碱出山东济宁诸处,彼人采篙寥之属,晒干烧灰,以水淋汁,久则凝淀如石,洗衣发面,亦去垢发面。这里的“石碱”是指
A.KOH B.KAl (SO4)2 C.KHCO3 D.K2CO3
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:
,含有2NA个S-S键
难度: 中等查看答案及解析
-
一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
难度: 中等查看答案及解析
-
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
( )

A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
难度: 中等查看答案及解析
-
绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
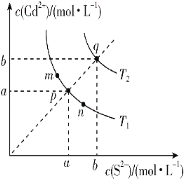
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
难度: 中等查看答案及解析
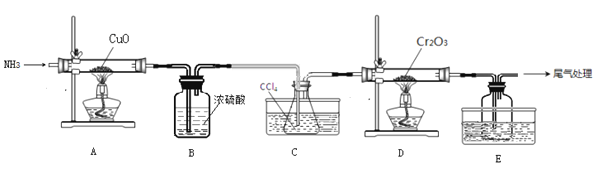
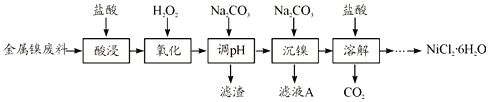
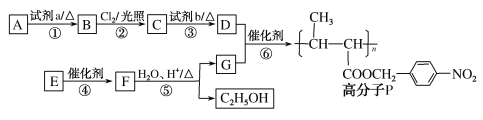
 ,以乙醇为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________
,以乙醇为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________