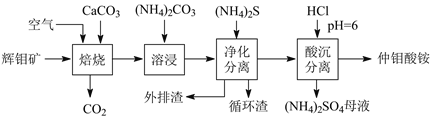
-
化学与生活密切相关。下列叙述错误的是
A.用大豆酿制酱油时,蛋白质水解生成了氨基酸
B.医用防护口罩中使用的聚丙烯熔喷布,其生产原料来自石油裂解
C.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
D.古代烧制瓷器的主要原料是石灰石和石英砂
难度: 简单查看答案及解析
-
下列关于有机物的说法错误的是
A.环戊二烯(
)分子中所有原子共平面
B.乙二醇既能发生氧化反应,又能发生聚合反应
C.乙酸和甲酸甲酯分子中所含的共用电子对数相等
D.分子式为C4H8O2且能发生水解反应的有机物有4种
难度: 简单查看答案及解析
-
W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
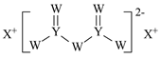
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
难度: 中等查看答案及解析
-
下列实验能达到目的的是
选项
目 的
实 验
A
加快稀溶液中草酸与KMnO4的反应
向溶液中加入少量MnSO4固体
B
检验海带中的碘元素
向海带灰浸取液中滴加淀粉溶液
C
除去食盐水中的少量BaCl2
向食盐水中通入过量的CO2
D
制备少量氨气
将硝酸铵与氢氧化钙固体混合加热
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。亚磷酸(H3PO3)为中强的二元酸,关于亚磷酸及其常温下pH=3的溶液,下列说法正确的是
A.1 mol H3PO3所含O-H键数目为3NA
B.每升该亚磷酸溶液中的H+数目为0.003NA
C.溶液中c(H2PO3-)+2c(HPO32-)+c(OH-)=10-3 mol/L
D.向该溶液中加入Na2HPO3固体,c(H3PO3)增大
难度: 中等查看答案及解析
-
Mg-VOCl2电池是一种基于阴离子传导的新型二次电池,其简化装置示意图如下。总反应为Mg+2VOCl2
MgCl2+2VOCl,下列说法错误的是

A.采用Mg作电极材料比Li的安全性更高
B.为该电池充电时Mg电极应与电源的正极相连
C.放电时正极反应为VOCl2+e-= VOCl+Cl-
D.放电过程中Cl-穿过复合离子液体向Mg移动
难度: 简单查看答案及解析
-
将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50 ℃时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
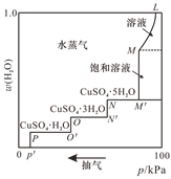
A.曲线L-M对应溶液中无硫酸铜晶体析出
B.曲线M-M ´ 对应溶液溶质的质量分数保持不变
C.曲线M ´ - N对应体系存在平衡:CuSO4(饱和溶液)
CuSO4·5H2O(s)+H2O(g)
D.当容器中压强低于p´ 后得到无水硫酸铜
难度: 中等查看答案及解析

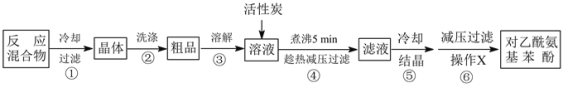


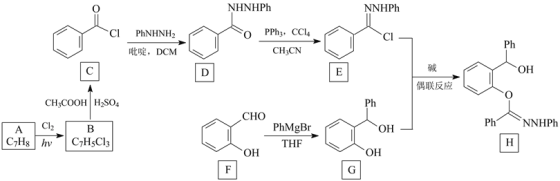
 和化合物D为原料制备
和化合物D为原料制备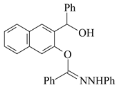 ,
,