-
下列能级中轨道数为5的是( )
A. S能级 B. P能级 C. d能级 D. f能级
难度: 简单查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
下列变化需要吸收能量的是 ( )
A.1s22s22p63s1→1s22s22p6 B.3s23p5→3s23p6
C.2px→2pz D.2H→H—H
难度: 中等查看答案及解析
-
下列常见分子的中心原子的杂化轨道类型是sp的是 ( )
A.BF3 B.CH4 C.SO2 D.CO2
难度: 中等查看答案及解析
-
按照第一电离能由大到小的顺序排列错误的是( )
A.Be、Mg、Ca B.Na、Mg、Al C.He、Ne、Ar D.Li、Na、K
难度: 简单查看答案及解析
-
已知某元素+2价离子的核外电子排布式为1s22s22p63s23p63d9,该元素在周期表中的位置是( )
A.第三周期Ⅷ族,p区 B.第三周期ⅤB族,d区
C.第四周期ⅠB族,ds区 D.第四周期ⅤB族,f区
难度: 简单查看答案及解析
-
下列描述正确的是 ( )
①CS2为V形的极性分子 ②
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的中心原子均采用sp3杂化
A.①③ B.②④ C.①② D.③④
难度: 中等查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A.CO和N2 B.O3和SO2
C.CO2和N2O D.N2H4和C2H4
难度: 中等查看答案及解析
-
若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.离子半径aAm+<bBn-
B.原子半径A<B
C.A的原子序数比B的原子序数大(m+n)
D.b=a-n-m
难度: 中等查看答案及解析
-
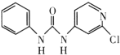
下列说法正确的是( )
A.1 mol N2分子中的π键与1 mol CO2分子中的π键的数目之比为2∶1
B.稳定性:甲烷>乙烯
C.强度:氢键>化学键>范德华力
D.沸点:
难度: 中等查看答案及解析
-
下列的晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
难度: 中等查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序。若以E表示某能级的能量,下列能量大小顺序中正确的是( )
A.E(3s)>E(3p)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)
难度: 中等查看答案及解析
-
下列关于丙烯(CH3—CH=CH2)的说法正确的( )
A.丙烯分子有2个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
难度: 中等查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于d区的是( )
A.Mn B.Zn C.As D.Ba
难度: 中等查看答案及解析
-
下列各组指定的元素,不能形成AB2型化合物的是( )
A.2s22p2和2s22p4 B.3s1和3s23p5
C.3s2和2s22p5 D.3s23p4和2s22p4
难度: 中等查看答案及解析
-
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是( )
A.氢键;分子间作用力;非极性键 B.氢键;极性键;分子间作用力
C.氢键;分子间作用力;极性键 D.分子间作用力;氢键;非极性键
难度: 中等查看答案及解析
-
下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )
A.CO2 B.H2O C.
D.CCl4
难度: 中等查看答案及解析
-
有5种元素X、Y、Z、Q、T。X原子最外层M层上有2个未成对电子且无空轨道;Y原子的价电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2O3
B.T的一种单质的空间构型为正四面体形,键角为
C.X和Q结合生成的化合物为共价化合物
D.ZO2是极性键构成的非极性分子
难度: 中等查看答案及解析
-
下列有机物的分类正确的是( )
A.
属于醇类化合物
B.
属于芳香族化合物
C.
属于脂环化合物
D.CH3CH(CH3)2属于链状化合物
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4] 2+
C.向反应后的溶液加入乙醇,溶液没有发生变化
D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 简单查看答案及解析
-
科学家发现铂的两种化合物a和b(见图),实验测得a和b具有不同的性质,且a具有抗癌作用,而b没有。下列关于a、b的叙述错误的是 ( )
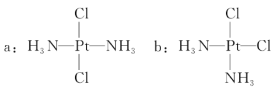
A.a和b互为同分异构体 B.a和b的空间构型是平面四边形
C.a和b互为镜像的关系 D.a和b分别是非极性分子和极性分子
难度: 中等查看答案及解析
-
下列化合物中含有手性碳原子的是( )
A.CH2F2 B.
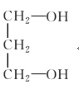
C.CH3CH2OH D.
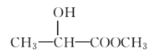
难度: 中等查看答案及解析
-
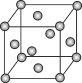
由硼和镁两种元素组成化合物可为超导材料,下图为该化合物的晶体结构单元示意图:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
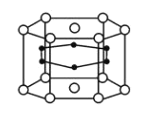
A.Mg5B12 B.MgB2 C.Mg2B D.Mg3B2
难度: 简单查看答案及解析
-
下列系统命名法正确的是 ( )
A.2-甲基-4-乙基戊烷 B.2,3-二乙基-1-戊烯
C.2-甲基-3-丁炔 D.对二甲苯
难度: 简单查看答案及解析
-
在己烷的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析