-
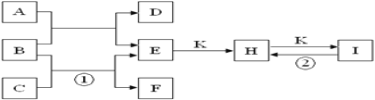
将一定量的氯气通入60mL10mol/L.热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO 和NaClO3的共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3mol
B. 反应后的溶液中,n(Na+): n(Cl-)可能为7 :3
C. 该反应的氧化产物为NaClO3
D. n(NaCl):n(NaClO) :n(NaClO3)可能为11: 2: 1
难度: 困难查看答案及解析
-
下列各组物质中,键的类型不同的是( )
A. HCl和HNO3 B. H2O和NH3 C. Na2S和NaCl D. CCl4和Na2O
难度: 中等查看答案及解析
-
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+ B.溶液中一定含Fe2+
C.剩余固体一定含Cu D.加入KSCN溶液一定不变红色
难度: 中等查看答案及解析
-
下列氯化物中,既能由金属和氯气直接参与化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2 B.FeCl2 C.MgCl2 D.FeCl3
难度: 中等查看答案及解析
-
ETH天文研究报道称组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
A.20Ne和22Ne互为同位素 B.20Ne和22Ne互为同素异形体
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne的中子数相同
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.HCl的电子式
B.Cl-的结构示意图
C.CO2的电子式
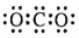 D.质量数为37的氯原子
D.质量数为37的氯原子 难度: 简单查看答案及解析
-
将一块金属钠投入到滴有紫色石蕊试液的烧杯中,你认为甲同学可观察的现象有( )
①钠投入水中,沉入水底; ②钠立即与水反应,并有气体产生;
③钠熔成闪亮的小球; ④小球在水面上四处游动;
⑤有“嘶嘶”的响声发出 ⑥反应后溶液变红;
A.①②③④ B.②③④⑤ C.③④⑥ D.②④⑤⑥
难度: 简单查看答案及解析
-
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.空气、硫酸铜、硫酸 B.硫酸、盐酸、纯碱
C.氧化铁、胆矾、熟石灰 D.硝酸、氢氧化铁胶体、火碱
难度: 简单查看答案及解析
-
若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数的值)
A.
B.
C.
D.
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.一个NO分子质量为ag,一个NO2分子质量是bg,则NA个O2的质量为2(b-a)NAg
B.常温常压下,22.4LCO2中含有NA个CO2分子
C.1.0L1.0mol·L-1的NaClO水溶液中含有的氧原子数为NA
D.含有NA个阴离子的Na2O2质量为39g
难度: 中等查看答案及解析
-
离子Rn-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目为( )
A.A-n-x B.A-n+x C.A+n+x D.A+n-x
难度: 简单查看答案及解析
-
下列有关碱金属元素和卤素的说法中,错误的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低
D.钾与水的反应比钠与水的反应更剧烈
难度: 简单查看答案及解析
-
在反应H2+Cl2=2HCl中,已知断开1 mol H—H需要能量436 kJ,断开1 molCl—Cl需要能量243 kJ,断开1 mol H—Cl需要能量431 kJ,判断该反应是( )
A.放出83 kJ热量 B.放出183 kJ热量
C.反应总能量低于生成物的总能量 D.吸收183 kJ热量
难度: 简单查看答案及解析
-
下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以CH2Cl2有两种不同构型
B.甲烷可以与氯气在加热的条件下发生取代反应
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在元素周期表的左下角可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
难度: 中等查看答案及解析
-
下列关于硅单质及其化合物的说法中错误的是( )
A.陶瓷、玻璃、水泥、水晶饰品等,都是硅酸盐产品
B.常温下,单质硅的性质稳定,与强酸、强碱都很难发生反应
C.高纯硅可用于制造太阳能电池,高纯二氧化硅可用于制造光导纤维
D.某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
难度: 中等查看答案及解析
-
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 L C.1.8 L D.2 L
难度: 中等查看答案及解析