-
下列叙述中错误的是( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的化学性质基本相同
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
难度: 简单查看答案及解析
-
X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为( )
A.HX B.H2X C.XH3 D.XH4
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子最外层电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
提出元素周期律并绘制了第一个元素周期表的科学家是
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
难度: 简单查看答案及解析
-
化学与能源开发、环境保护、生产生活等密切相关。下列叙述错误的是
A. 光催化水制氢比电解水制氢更节能环保
B. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C. 开发利用可再生能源,可减少化石燃料的使用
D. 改进汽车尾气净化技术,可减少大气污染物的排放
难度: 简单查看答案及解析
-
已知某元素的原子结构示意图为
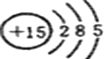 。试推测其在元素周期表的位置为
。试推测其在元素周期表的位置为A.第二周期ⅡA族 B.第二周期ⅥA族
C.第三周期ⅡA族 D.第三周期VA族
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.氧化性强弱:F2<Cl2 B.金属性强弱:K<Na
C.酸性强弱:H2SiO3<H2CO3 D.碱性强弱:NaOH<Mg(OH)2
难度: 简单查看答案及解析
-
关于如图所示装置的叙述,正确的是
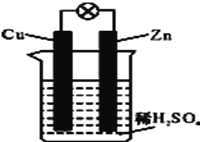
A.Cu为负极, Zn为正极 B.电子从铜片经外电路流向锌片
C.负极反应为:Zn-2e-=Zn2+ D.该装置是将电能转化为化学能
难度: 简单查看答案及解析
-
下列物质中,既含有非极性共价键又含有极性共价键的是
A. NaOH B. CO2 C. N2 D. N2H4
难度: 简单查看答案及解析
-
下列对能源的看法不合理的是
A.生物能是一种可再生能源,有广泛的前景
B.太阳能、氢能、核能、地热能都属于新能源
C.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
D.我国化石能源丰富且属于可再生能源,想用多少就用多少
难度: 简单查看答案及解析
-
下列物质中,含有共价键的离子化合物是
A.NaCl B.H2O C.KOH D.Cl2
难度: 简单查看答案及解析
-
下列性质的递变规律不正确的是
A. HCl、HBr、HI 稳定性依次减弱
B. Na、Mg、Al 的原子半径依次增大
C. NaOH、KOH、CsOH 碱性依次增强
D. Li、Na、K、Rb、Cs单质的失电子能力依次增强
难度: 中等查看答案及解析
-
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法确定
难度: 简单查看答案及解析
-
碘具有多种放射性同位素。
I俗称“碘131”,广泛地用于医学诊断,作为追踪剂和甲状腺内分泌失调症的治疗。下列有关
I叙述正确的是( )
A.碘元素的相对原子质量为131
B.
I是一种新发现的碘的核素
C.
I位于元素周期表中第四周期ⅦA族
D.
I核内的中子数与核外电子数之差为29
难度: 简单查看答案及解析
-
下列微粒半径大小比较正确的是
A.Na<Mg<Al<S B.I<Br<Cl<F
C.Na+<Mg2+<Al3+<O2- D.S2->Cl->Na+>Al3+
难度: 简单查看答案及解析
-
下列反应过程中的能量变化情况符合如图的是( )
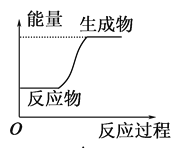
A.酸与碱的中和反应 B.镁和盐酸的反应
C.氧化钙和水反应 D.水发生分解反应
难度: 简单查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡。b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
已知阳离子R2+的原子核内有n个中子,R原子的质量数为m,则w g R2+所含有电子的物质的量是
A.
mol B.
mol
C.
mol D.
mol
难度: 简单查看答案及解析