-
下列关于太阳能、生物质能和氢能的利用说法不正确的是( )
A.农村推广建造沼气池,实现了生物质能向热能的转化
B.光﹣生物质能转换的本质是光﹣化学能的转换
C.科学家们预言,氢能将成为21世纪的重要能源
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
难度: 简单查看答案及解析
-
将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处,下列有关此实验的现象和结论的叙述不正确的是( )
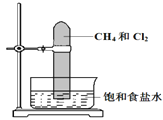
A.试管中气体的黄绿色逐渐变浅,水面上升
B.生成物只有三氯甲烷和氯化氢,在标准状况下均是气体
C.试管内壁有油状液滴形成
D.试管内有少量白雾
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热就可以发生
C.反应条件是加热的反应不一定都是吸热反应
D.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
难度: 简单查看答案及解析
-
等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关实验现象和结论中,正确的是( )
①反应后Cl2完全反应而CH4有剩余
②瓶内壁有油状液滴生成
③最后有CH4、Cl2、CH3Cl、CH2Cl2、CHCl3、CCl4、HCl七种物质共存
④只有CH3Cl和HCl两种产物
A.①② B.②③ C.③④ D.①④
难度: 简单查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。关于该电池的叙述正确的是( )
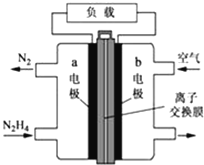
A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣=N2↑+4H2O
难度: 中等查看答案及解析
-
下列物质的变化过程中,没有化学键断裂的是( )
A.HCl溶解于水 B.NaCl晶体的熔化
C.干冰升华 D.氯化铵的受热分解
难度: 简单查看答案及解析
-
反应 4NH3+5O2
4NO+6H2O(g)在 5L 的密闭容器中进行,半分钟后,NO 的物质的量增 加了 0.3mol,则下列反应速率正确的是 ( )
A.v(O2)=0.01mol/(L·s) B.v(NO)=0.008 mol/(L·s)
C.v(H2O)=0.015 mol/(L·s) D.v(NH3)=0.002 mol/(L·s)
难度: 简单查看答案及解析
-
已知一定温度下,在2L的密闭容器中,合成氨反应N2(g)+3H2(g)
 2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下:N2
H2
NH3
起始时各物质的物质的量/mol
2.0
6.0
0
2s末各物质的物质的量/mol
1.2
3.6
1.6
以氢气来表示该化学反应的反应速率为( )
A.0.2mol·L-1·s-1 B.0.4mol·L-1·s-1
C.0.6mol·L-1·s-1 D.0.8mol·L-1·s-1
难度: 简单查看答案及解析
-
在一定温度下,可逆反应:A2(g)+B2(g)
2AB(g),达到平衡的标志是( )
A.容器的总压强不随时间而变化
B.单位时间内生成nmolA2同时就有2nmolAB生成
C.单位时间内有nmolB2发生反应的同时有nmolAB分解
D.单位时间内有nmolA2生成的同时有nmolB2生成
难度: 简单查看答案及解析
-
反应A(g) +3B(g)
2C(g) +2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A.v(A)=0.15mol/(L·min) B.v(B)=0.04mol/(L·s)
C.v(C)=0.03 mol/(L·s) D.v(D)=0.4 mol/(L·min)
难度: 简单查看答案及解析
-
四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是( )
A.20℃,10mL硫酸 B.20℃,5mL硫酸,5mL水
C.30℃,5mL硫酸,2mL水 D.30℃,4mL硫酸,3mL水
难度: 简单查看答案及解析
-
在10L密闭容器中,1molA和3molB在一定条件下反应:A(g)+xB(g)
2C(g),2min后反应达到平衡时,测得混合气体共3.4mol,生成0.4molC,则下列计算结果不正确的是( )
A.平衡时,物质的量比A:B:C=2:11:4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为0.04mol·L-1·min-1
难度: 中等查看答案及解析
-
用6 g CaCO3与100 mL稀盐酸反应制取少量的CO2,反应过程中生成的CO2的体积(已折算为标准状况)随反应时间变化的情况如右图所示。下列说法正确的是
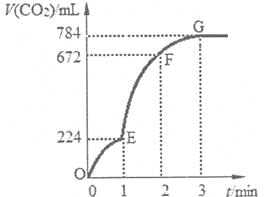
A.OE段表示的平均反应速率最快,可能的原因是该反应是放热反应
B.EF段用HC1浓度的减小表示的该反应的平均反应速率为0.2 mol/(L·min)
C.在F点收集到的CO2的体积最大
D.在G点以后收集的CO2的量不再增多,原因是稀盐酸已反应完全
难度: 中等查看答案及解析
-
在C(s)+CO2(g)
2CO(g)的反应中,采取下列措施:能够使反应速率增大的措施是( )
①缩小体积,增大压强②增加碳的量③恒容通入CO2④恒容下充入N2⑤恒压下充入N2
A.①④ B.②③⑤ C.①③ D.①②④
难度: 简单查看答案及解析
-
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成B的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成nmolA,同时生成2nmolC
D.A、B、C的分子数之比为1:3:2
难度: 简单查看答案及解析
-
少量铁片与l00mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O②加KNO3溶液③滴入几滴浓盐酸④加入少量铁粉⑤加NaCl溶液⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
难度: 简单查看答案及解析
-
在一定温度下的定容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中能表明反应已达到平衡状态的是
①混合气体的压强不变
②混合气体的密度不变
③C(g)的物质的量浓度不变
④容器内A、C、D三种气体的浓度之比为2:1:1
⑤单位时间内生成n molD,同时生成2n mol A
⑥单位时间内生成n molC,同时消耗n mol D
A.①②③ B.③④⑥ C.②③⑤⑥ D.只有 ③
难度: 中等查看答案及解析
-
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )
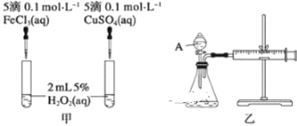
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
难度: 简单查看答案及解析
-
某一可逆反应A+3B
2C,改变下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度
C.增大压强 D.使用催化剂
难度: 简单查看答案及解析
-
公元前一世纪,我国已使用天然气,天然气的主要成分为甲烷。下列关于甲烷的叙述中,错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
D.甲烷的四种取代物都难溶于水
难度: 简单查看答案及解析
-
在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是
A.CH3Cl B.CH2Cl2 C.CHCl3 D.HCl
难度: 简单查看答案及解析
-
在密闭容器里,A与B 反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为 ( )
A.2A + 3B = 2C B.A + 3B = 2C C.3A + B = 2C D.A + B = C
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是( )
A.原子半径:Y<Z<W
B.Z在化合物中呈+1价
C.Y与W可形成离子化合物
D.W的单质能在Y的单质中燃烧生成WY3
难度: 简单查看答案及解析
-
根据反应:2Ag++Cu═Cu2++2Ag,设计如图所示原电池,下列说法错误的是
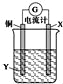
A.X可以是银或石墨 B.电子从铜电极经外电路流向X电极
C.Y是硫酸铜溶液 D.X极上的电极反应式为Ag++e﹣═Ag
难度: 中等查看答案及解析
-
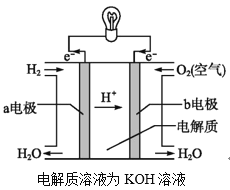
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆−氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2−)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
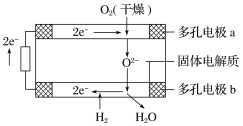
A.有O2放电的a极为电池的负极
B.O2−移向电池的正极
C.b极对应的电极反应为2H2−4e−+2O2−
2H2O
D.a极对应的电极反应为O2+2H2O+4e−
4OH−
难度: 中等查看答案及解析