-
浓硫酸具有很多重要的性质,在于含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.吸水性 C.脱水性 D.强氧化性
难度: 简单查看答案及解析
-
下列实验室制取、干燥、收集NH3并进行尾气处理的装置和原理能达到实验目的的是
A.
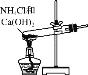 制取NH3 B.
制取NH3 B.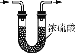 干燥NH3
干燥NH3C.
收集NH3 D.
处理尾气
难度: 中等查看答案及解析
-
下列物质中,常温下可以使用铁制的容器来储存的是( )
A.稀硝酸 B.浓硝酸 C.浓盐酸 D.稀盐酸
难度: 简单查看答案及解析
-
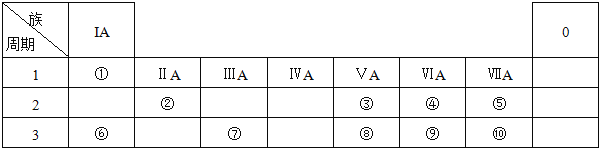
硒是人体必需的微量元素,图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
难度: 中等查看答案及解析
-
元素性质呈周期性变化根本原因是
A.核电荷数逐渐增大 B.元素的相对原子质量逐渐增大
C.核外电子排布呈周期性变化 D.元素的主要化合价呈周期性变化
难度: 中等查看答案及解析
-
下列顺序排列正确的是
A. 元素的非金属性:P>S>Cl B. 原子半径:F>Cl>I
C. 碱性强弱:KOH>NaOH>Mg(OH)2 D. 酸性强弱:HIO4>HBrO4>HClO4
难度: 中等查看答案及解析
-
下列各元素性质递变情况中,错误的是
A.Li、Be、B原子最外层电子数依次增多 B.N、O、F元素最高正化合价依次升高
C.Mg、Al、Si原子半径依次减小 D.P、S、Cl元素的负化合价依次为-3、-2、-1
难度: 中等查看答案及解析
-
下列分子的电子式书写正确的是
A. 氨气
B. 四氯化碳
C. 氮气
D. 二氧化碳
难度: 简单查看答案及解析
-
含有共价键的离子化合物是( )
A.H2O2 B.CaCl2 C.CCl4 D.NaOH
难度: 简单查看答案及解析
-
关于化学键的叙述正确的是
A.离子化合物中只存在离子键
B.非金属元素组成的化合物中可能存在离子键
C.由不同种元素组成的多原子分子里,一定只存在极性共价键
D.含金属元素的化合物中一定存在离子键
难度: 简单查看答案及解析
-
已知a An+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A. 原子序数:b>a>c>d B. 最高价氧化物对应水化物的碱性:B>A
C. 四种离子的电子层结构相同,因而离子的性质也相同 D. 气态氢化物的稳定性:D>C
难度: 中等查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
难度: 中等查看答案及解析
-
如图所示,对 A 生成 C 的反应,下列结论正确的是( )
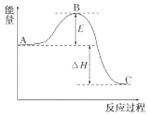
A.该反应为吸热反应
B.该反应进行时,一定有能量放出
C.A 比 C 稳定
D.该反应不需要加热一定就可以进行
难度: 简单查看答案及解析
-
NO是氮元素的一种氧化物。下图表示N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列有关反应和NO性质的说法中,正确的是
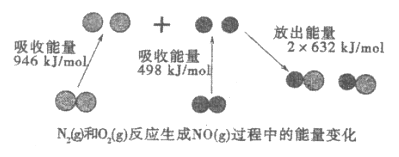
A.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
B.1mol N2(g)和1mol O2(g)反应生成2molNO(g),放出能量180 kJ
C.在1 L的密闭容器中N2(g)和O2(g)反应生成NO(g),10分钟内减少1mol N2,则10分钟内化学反应的的平均速率可表示为v(NO)=0.1mol/(L·min)
D.N2(g)分子中化学键键能大于O2(g)分子中化学键键能
难度: 中等查看答案及解析
-
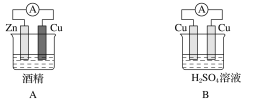
银锌纽扣电池,其电池的电池反应式为:Zn + Ag2O + H2O =Zn(OH)2 + 2Ag
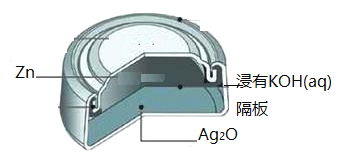
下列说法不正确的是
A. 锌作负极
B. 正极发生还原反应
C. 电池工作时,电流从Ag2O经导线流向Zn
D. 负极的电极方程式为:Zn-2e- = Zn2+
难度: 中等查看答案及解析
-
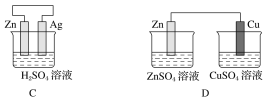
如图为原电池装置,a为锌棒、b为碳棒,下列说法不正确的是

A. a是正极,b是负极
B. a极上发生了氧化反应
C. 电子从a极通过导线流向b极
D. 碳棒上有气体逸出,溶液中H+浓度减小
难度: 中等查看答案及解析
-
用铁片与1 mol·L-1 H2SO4反应制取氢气时,下列措施不能使氢气生成速率加快的是
A. 加入少量的CuSO4溶液 B. 改用18 mol·L-1硫酸溶液反应
C. 不用铁片,改用铁粉 D. 加热
难度: 简单查看答案及解析
-
可逆反应
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成
的同时生成
②单位时间内生成
的同时生成
③用
表示的反应速率之比为
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 简单查看答案及解析
-
四位同学同时进行反应
的速率测定实验,分别测得反应速率如下:
①v(A)=0.15mol/(L•s),②v(B)=0.6mol/(L•s),③v(C)=0.4mol/(L•s),④v(D)=0.45mol/(L•s)。其中反应进行得最快的是( )
A. ① B. ② C. ③ D. ④
难度: 简单查看答案及解析
-
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1 B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1 D. B的平均反应速率为0.2 mol·L-1·s-1
难度: 中等查看答案及解析
-
下列说法中不正确的是 ( )
A.乙醇与金属钠反应时,是乙醇分子中的O—H键断裂
B.检验乙醇中是否含有水可加入少量无水硫酸铜,若变蓝色则含水
C.禁止用工业酒精配制饮用酒和调味用的料酒
D.甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物
难度: 简单查看答案及解析
-
下列烷烃能生成一种一氯代物,则该烷烃的分子式不可能的是
A.CH4 B.C2H6 C.C4H10 D.C5H12
难度: 中等查看答案及解析
-
如图是四种常见有机物分子的比例模型示意图。下列说法正确的是( )
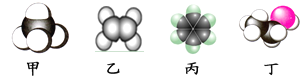
A.甲是甲烷,甲烷的二氯取代产物只有一种结构
B.乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色
C.丙是苯,苯结构比较稳定,不能发生氧化反应
D.丁是乙酸,一定条件下乙酸能跟乙醇发生酯化反应
难度: 简单查看答案及解析
-
下列实验方案不合理的是
A.鉴定蔗糖在硫酸催化作用下的水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液
B.鉴别织物成分是真丝还是人造丝:用灼烧的方法
C.鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液
D.鉴别乙烷和乙烯:将两种气体分别通入溴的四氯化碳溶液中
难度: 中等查看答案及解析
-
下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是
A.加热氧化铝 B.加热氧化汞
C.电解熔融氯化钠 D.氢气还原氧化铁
难度: 中等查看答案及解析