-
化学与人类生产、生活密切相关。下列有关说法不正确的是
A.疫情期间,“网课”成了我们的主要学习方式,网络光缆的主要成分是晶体硅
B.驰援武汉首次使用我国自主研发大飞机“运20”的机身材料采用了大量低密度、高强度的铝锂合金
C.李白的《黄鹤楼送孟浩然之广陵》中“故人西辞黄鹤楼,烟花三月下扬州”,”烟花”不是焰色反应
D.“绿蚁新醅酒,红泥小火炉”中的“红泥”是因其含有氧化铁
难度: 中等查看答案及解析
-
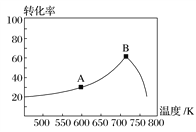
研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
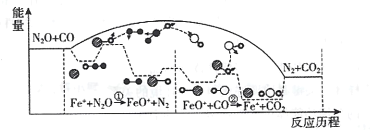
A.反应中Fe+是催化剂,FeO+是中间产物
B.当有14g N2生成时,转移1mol e−
C.升高温度,总反应的平衡常数K减小
D.总反应速率由反应②的速率决定
难度: 中等查看答案及解析
-
环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是( )
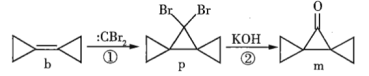
A.b的所有原子都在同一个平面内
B.p在氢氧化钠的醇溶液中加热生成烯烃
C.m的同分异构体中属于芳香化合物的共有5种
D.m不能发生加成反应
难度: 中等查看答案及解析
-
下列根据实验操作和实验现象所得出的结论中,正确的是
选项
实验操作
现象
结论
A
常温下分别测定等浓度的KNO2、KCl溶液的pH
pH值:KNO2>KCl
非金属性:Cl>N
B
打磨后的铝片投入沸水中,加热一段时间,取出铝片,用一束光照射溶液
加热,铝片表面无明显现象;用光照射溶液时,有一条光亮的“通路”
铝与热水发生了反应
C
将某溶液与盐酸反应产生的气体通入澄清石灰水中
澄清石灰水变浑浊
某溶液中一定含有HCO3-或CO32-
D
向Cu(OH)2沉淀中分别滴加盐酸和氨水
沉淀均能溶解
Cu(OH)2为两性氢氧化物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的K层电子数与最外层电子数之比为2∶7,X与W同主族,Y与Z均处于元素周期表的偶数族,Z与W的原子序数相差3。下列说法正确的是
A.原子半径:X<Y<Z<W
B.常温下,Y、W形成的化合物的水溶液的pH<7
C.X氢化物的水溶液用带玻璃塞的试剂瓶保存
D.lmol X、Y形成的化合物中含有2mol极性键
难度: 中等查看答案及解析
-
常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgCl)数量级为10−10。下列叙述正确的是
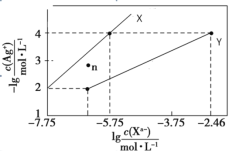
A.图中X线代表的Ag2C2O4
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl−)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4+2Cl−=2AgCl+ C2O42-的平衡常数为10−0.71
难度: 困难查看答案及解析
-
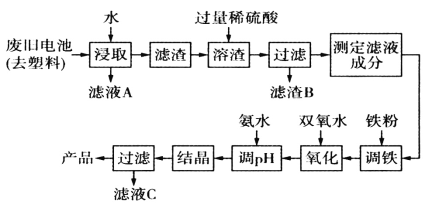
用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
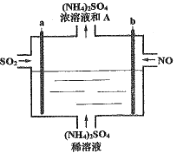
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
难度: 中等查看答案及解析