-
化学与生产、生活等密切相关,下列说法正确的是
A.水壶中有很多水垢,其主要成分为碳酸镁、碳酸钙
B.单词“china”可表示瓷器,其主要成分为二氧化硅
C.用热的纯碱溶液和用汽油去油污均发生化学变化
D.光导纤维是现代通讯的重要材料,遇强碱会“断路”
难度: 中等查看答案及解析
-
分子式为C8H9Cl的芳香族化合物(不含立体异构)有
A.14种 B.15种 C.16种 D.18种
难度: 困难查看答案及解析
-
工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
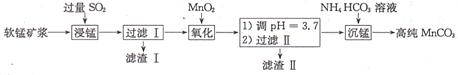
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+一定不含K+
B
将稀盐酸滴入碳酸钠溶液中,有无色气体产生
非金属性:Cl>C
C
向淀粉溶液中加入稀硫酸并加热,再加入新制的氢氧化铜,加热,未见有砖红色沉淀产生
淀粉没有水解
D
相同条件下,向两支试管中均加入4mL0.01mol•L-1KMnO4溶液和2mL0.1 mol•L-1H2C2O4溶液,再向其中一支试管中快速加入少量MnSO4固体,加有MnSO4的试管中溶液褪色较快
MnSO4对该反应有催化作用
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
燃料电池发电站,与普通火力发电站相比,其有害物排放少,运行噪音低,被誉为“绿色”发电站。如图为某空气燃料电池工作原理,下列说法错误的是
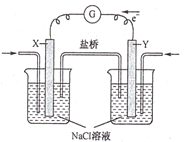
A.该电池工作时,X电极附近的溶液pH升高
B.该电池工作时,盐桥中的阴离子向Y电极移动
C.若用甲醇作燃料,则X电极上的反应为CH3OH-6e-+H2O=CO2+6H+
D.若用甲烷作燃料,当电路中通过0.8mol电子时,则消耗甲烷的质量为1.6g
难度: 中等查看答案及解析
-
X、Y、Z、R为短周期主族元素.X、Y、Z分别位于三个不同的短周期,且Z在短周期金属性最强,R是地壳中含量最高的金属元素。Y与X形成的简单气态化合物在标准状况下的密度为0.76g•L-1,下列说法不正确的是
A.X能与Z形成离子化合物
B.Y的最高价氧化物对应的水化物是强酸
C.Y与Z形成的化合物水溶液呈中性
D.R的单质能溶于Z的最高价氧化物的水化物溶液中
难度: 中等查看答案及解析
-
常温下,用0.lmol•L-1的盐酸滴定10.0mL0.lmol•L-1Na2A溶液,所得滴定曲线如图所示.下列说法正确的是
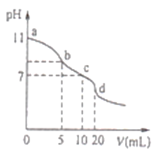
A.常温下,A2-的水解常数Khl(A2-)的数量级为10-6
B.b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c点溶液中:c(HA-)+c(A2-)+c(H2A)=0.lmol•L-1
D.d点溶液中:c(A2-)+c(HA-)=c((H+)<c(OH-)
难度: 困难查看答案及解析
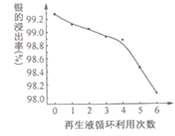
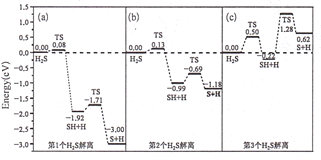
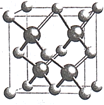
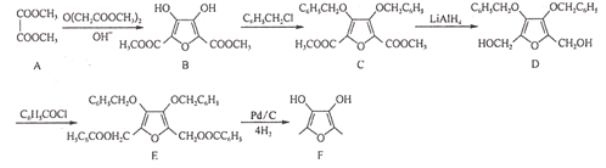
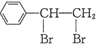 的合成路线:________。(无机试剂任选)。
的合成路线:________。(无机试剂任选)。