-
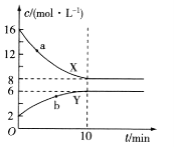
X、Y、Z、M、N代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<X<Y<Z C.N<M<Y<X<Z D.X<Z<N<M<Y
难度: 简单查看答案及解析
-
下列说法中正确的是
A.水玻璃和石英的主要成分都是SiO2
B.Si、SiO2和SiO32-等均可与NaOH 溶液反应
C.二氧化硅属于酸性氧化物,不溶于任何酸
D.高岭石[Al2(Si2O5)(OH)4]可表示为Al2O3·2SiO2·2H2O
难度: 中等查看答案及解析
-
物质的化学性质在日常生活和生产中有着广泛的运用。下列有关说法正确的是
A.FeCl3可以作止血剂是因为Fe3+具有强氧化性
B.Fe 比Cu 活泼,因此FeCl2溶液可以腐蚀线路板上的Cu
C.臭氧是一种有特殊臭味、氧化性极强的气体,可用作餐具的消毒剂
D.漂白粉在空气中易变质是因为空气中的CO2会与CaCl2反应生成CaCO3
难度: 中等查看答案及解析
-
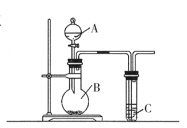
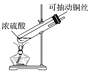
探究铜和浓硫酸的反应,下列装置或操作错误的是
甲
 乙
乙  丙
丙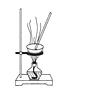
A.上下移动装置甲中的铜丝可控制SO2的生成
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色
D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体
难度: 简单查看答案及解析
-
下列说法正确的是
A.因SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.向 50 mL 18.4 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量小于0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于5.6
D.等物质的量的SO2和Cl2混合后通入装有湿润有色布条的集气瓶中,漂白效果更好
难度: 中等查看答案及解析
-
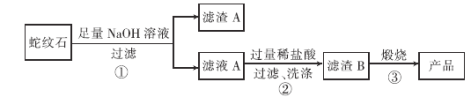
为了除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂均过量):
称取粗盐滤液
精盐。
下列叙述正确的是A.第④发生的反应只有CaCl2+Na2CO3=CaCO3↓+2NaCl
B.③中的试剂可以是NaOH溶液也可以是KOH溶液
C.步骤②和④顺序可以颠倒
D.⑤步操作用到的玻璃仪器只有烧杯、漏斗和玻璃棒
难度: 简单查看答案及解析
-
某沼气成分是CH4和CO2。取2L该沼气与4LO2点燃充分反应后,除去水分,剩余气体的体积为3L。该沼气中CH4和CO2的物质的量之比为(气体体积均在标准状况下测定)( )
A.1:3 B.1:1 C.3:1 D.4:1
难度: 中等查看答案及解析
-
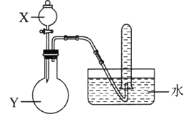
用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
A
B
C
D
X中试剂
浓盐酸
双氧水
浓硫酸
浓氨水
Y中试剂
KMnO4
MnO2
Cu
NaOH
气体
Cl2
O2
SO2
NH3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子构成HmX分子。在agHmX中所含质子的物质的量是
A.
mol B.
(A-N)mol
C.
(A-N)mol D.
(A-N+m)mol
难度: 中等查看答案及解析
-
下列各表均表示元素周期表的一部分(表中数字代表元素的原子序数),其中正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.FeCl3溶液中加入足量的氨水:Fe3++3OH-=Fe(OH)3↓
C.Ba(OH)2与CuSO4溶液反应:Ba2++SO42-=BaSO4↓
D.氧化铝与NaOH溶液反应:Al2O3+2OH-=2AlO2-+2H2O
难度: 中等查看答案及解析
-
将一定量Fe、FeO和Fe2O3的混合物加入240 mL 2 mol·L-1稀硝酸中,恰好完全反应,放出1.344 L(标准状况下)NO气体,往所得溶液中加入酸性KMnO4溶液,无明显现象。若用足量的H2在加热条件下与相同质量的上述混合物充分反应,能得到铁的质量为
A.6.72g B.7.84g C.8.96g D.11.76g
难度: 中等查看答案及解析
-
四个体积相同密闭容器中分别充入一定量SO2和O2,开始反应时,按反应速率由大到小的顺序正确是
甲:500℃,10molSO2和5molO2反应 乙:500℃,V2O5作催化剂,10molSO2和5molO2反应
丙:450℃,8molSO2和5molO2反应 丁:500℃,8molSO2和5molO2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁 C.乙、甲、丁、丙 D.丁、丙、乙、甲
难度: 中等查看答案及解析
-
在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
难度: 简单查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
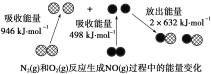
A.1 mol N2(g)和NA个 O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 简单查看答案及解析
-
在体积固定的密闭容器中发生反应:
。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.混合气体的密度不变
B.体系的压强不变
C.混合气体的平均相对分子质量不变
D.反应体系中乙醇的物质的量浓度不再变化
难度: 简单查看答案及解析
-
“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①为加快KClO3的分解速率,加入MnO2
②物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化也一定是化学变化
③燃烧时,液体燃料以雾状喷出可以提高燃料的燃烧效率
④因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
⑤需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
⑥为防止污染,在面粉厂、纺纱厂等场所要严禁烟火
A.①③④ B.①⑤⑥ C.②④⑥ D.①②③④⑥
难度: 简单查看答案及解析
-
已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)
2HI(g)的反应类型判断错误的是( )
A.放出能量的反应 B.吸收能量的反应
C.氧化还原反应 D.可逆反应
难度: 简单查看答案及解析
-
反应4A(g)+5B(g)
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 mol•L﹣1•s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
难度: 中等查看答案及解析