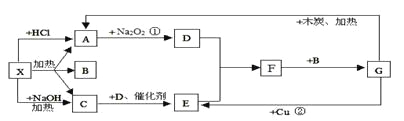
-
下列离子方程式的书写正确的是( )
A. 二氧化硫与NaOH溶液反应SO2+OH-===SO32-+H2O
B. 向FeCl2溶液中加氯水Fe2++Cl2===Fe3++2Cl-
C. 稀H2SO4和Ba(OH)2溶液混合Ba2++SO42-===BaSO4↓
D. Cl2与NaOH溶液反应Cl2+2OH-===Cl-+ClO-+H2O
难度: 简单查看答案及解析
-
A、B两种元素为某周期第ⅡA族和第ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为( )
①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.①③
B.②④
C.①③⑤
D.②④⑥
难度: 中等查看答案及解析
-
俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义。该原子的中子数与电子数之差是( )
A.61 B.114 C.175 D.289
难度: 中等查看答案及解析
-
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
难度: 简单查看答案及解析
-
下列各组化合物的性质比较中,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S
难度: 中等查看答案及解析
-
下列元素的最高价氧化物的水化物酸性最强的是( )
A.Br B.K C.S D.Cl
难度: 中等查看答案及解析
-
如图是Zn 和Cu 形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是
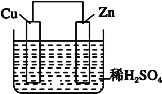
①Zn 为正极,Cu 为负极;
②H+向负极移动;
③电子是由 Zn 经外电路流向 Cu;
④Cu 极上有H2产生;
⑤若有 1mol 电子流过导线,则产生的 H2 为 0.5mol;
⑥正极的电极反应式为 Zn﹣2e﹣=Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
难度: 简单查看答案及解析
-
实验室可用下图所示装置干燥、收集某气体R,则R可能是
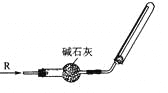
A.SO2 B.NH3 C.HCl D.Cl2
难度: 简单查看答案及解析
-
下图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )
A.P B.S C.Cl D.Si
难度: 中等查看答案及解析
-
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3=S↓+2NO2↑+2H2O
B.CuO+2HNO3=Cu(NO3)2+H2O
C.4HNO3
4NO2↑+O2↑+2H2O
D.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
难度: 简单查看答案及解析
-
一定温度下可逆反应N2(g)+3H2(g)
2NH3(g)达平衡的标志是( )
A.v正(N2)=v逆(N2) B.v正(N2)=3v正(H2)
C.v正(H2)=3v逆(NH3) D.N2、H2、NH3的体积比为1:3:2
难度: 简单查看答案及解析
-
下列说法中正确的是
A.纯净物中一定存在化学键
B.阴、阳离子间通过静电引力而形成的化学键叫做离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.离子化合物中可能含共价键,共价化合物中不含离子键
难度: 简单查看答案及解析
-
在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是
A.8.7g二氧化锰与50mL8mol·L-1浓盐酸共热制取氯气
B.19.2g铜与100mL12mol·L-1的硝酸反应
C.常温下,将5.4g铝片投入20mL18mol·L-1的硫酸中
D.将足量的Cu置于50mL18mol·L-1H2SO4溶液中加热
难度: 中等查看答案及解析
-
铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag = Tl++2Ag+ 。下列推断正确的是( )
A.Tl+的最外层有1个电子 B.Tl的金属性比Al 弱
C.Tl+的还原性比Ag强 D.Tl 能形成+3价和+1价的化合物
难度: 中等查看答案及解析
-
某反应由两步反应A→B→C构成,其反应能量量变化曲线如图所示,下列叙述正确的是( )
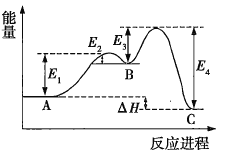
A.两步反应均为吸热反应 B.三种物质中C最稳定
C.A与C的能量差为
D.A→B的反应一定需要加热
难度: 简单查看答案及解析
-
下列反应中生成H2的速率最快的是( )
金属
酸溶液
温度
A
Mg
0.5 mol·L-1 H2SO4
20℃
B
Mg
1 mol·L-1 H2SO4
30℃
C
Zn
2 mol·L-1 HCl
20℃
D
Fe
1 mol·L-1 HCl
20℃
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1mol的氢氧根离子中的电子数目约为9NA
B.56 g铁片投入足量稀H2SO4中生成NA个SO2分子
C.标准状况下,11.2 L NH3中含有分子的数目为0.5NA
D.在铜与足量稀硝酸的反应中,每生成0.1 mol气体,转移电子的数目为0.2NA
难度: 中等查看答案及解析
-
下列叙述中,能说明金属a的活泼性肯定比金属b的活泼性强的是
A. a原子的最外层电子数比b原子的最外层电子数少
B. a原子电子层数比b原子的电子层数多
C. 1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D. 常温时,a能从水中置换出氢,而b不能
难度: 中等查看答案及解析
-
一学生用如图装置研究原电池原理,下列说法错误的是:
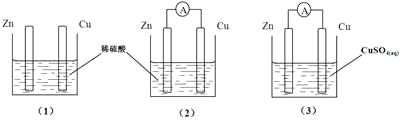
A.(3)图中Zn片增重质量与Cu棒减轻质量的比值为65:64
B.(2)图中如果两极上都有气体产生,则说明Zn片不纯
C.(1)图中铜棒上没有气体产生
D.(2)图与(3)图中正极生成物质质量比为1:32时,Zn棒减轻的质量相等
难度: 中等查看答案及解析
-
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A.Q1< Q2
B.石墨不如金刚石稳定
C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低
D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多
难度: 中等查看答案及解析