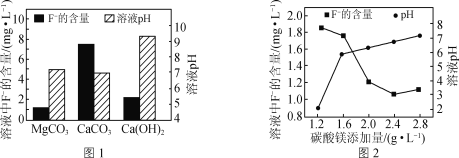
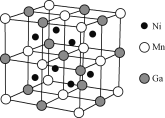
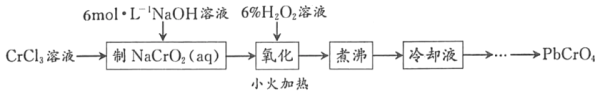
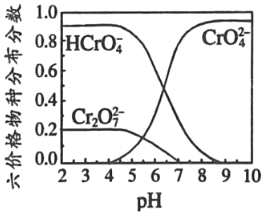
-
化学与人类的生产、生活密切相关。下列说法正确的是( )
A.废旧电池应集中处理的首要原因是回收利用其中的金属材料
B.新型冠状病毒对人类健康构成严重威胁,常用95%的酒精作新冠消毒剂
C.油脂属于高分子化合物,使用一定的油脂能促进人体对某些维生素的吸收
D.将少量二氧化硫添加于红酒中可以起到杀菌和抗氧化作用,是法律允许的做法
难度: 简单查看答案及解析
-
Mg(NH)2可发生水【解析】
Mg(NH)2+2H2O=N2H4+Mg(OH)2。下列表示相关微粒的化学用语正确的是( )A.中子数为8的氧原子:
O
B.N2H4的电子式:
C.镁原子的结构示意图:
D.水分子的比例模型:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A.氢氟酸具有弱酸性,可用于蚀刻玻璃
B.FeCl3易发生水解,可用作铜制线路板的蚀刻剂
C.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
D.漂白粉具有氧化性,可用于脱除烟气中SO2和NO等污染气体
难度: 简单查看答案及解析
-
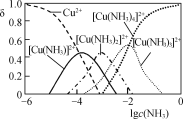
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.无色透明的溶液:Na+、Cu2+、SO42-、NO3-
B.0.1mol·L-1FeSO4溶液:Na+、K+、Cl-、NO3-
C.c(Fe3+)=1mol·L-1的溶液:K+、NH4+、SO42-、SO32-
D.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Ca2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列有关表述正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向溶有氨气的CaCl2溶液中通SO2能看到白色沉淀
C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度
D.Na2O、Na2O2组成元素相同,所以与CO2反应产物也相同
难度: 简单查看答案及解析
-
实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A.
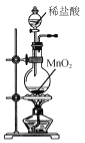 制取Cl2
制取Cl2B.
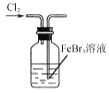 使Br-转化为Br2
使Br-转化为Br2C.
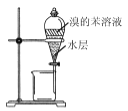 分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液D.
 将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向氨水中通入过量SO2:NH3·H2O+SO2=NH4++HSO3-
B.Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+H2↑
C.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-
NH3↑+H2O
D.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A.NaCl(aq)
NaOH
NaAlO2
B.CuO
Cu(OH)2
Cu2O
C.Ca(ClO)2(aq)
HClO(aq)
Cl2(g)
D.H2SO4(稀)
SO2(g)
Na2SO3(aq)
难度: 简单查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次增大。元素X是制备一种高效电池的重要材料,Y原子的最外层电子数是内层电子数的2倍,元素Z是地壳中含量最丰富的金属元素,W原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
A.原子半径:r(Y)<r(X)<r(Z)<r(W)
B.Y与氢形成原子比为1:1的化合物只有一种
C.Y可与W形成空间构型为直线形的共价化合物YW2
D.单质Z与Y、W对应的最高价氧化物的水化物都能够发生反应
难度: 简单查看答案及解析
-
2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
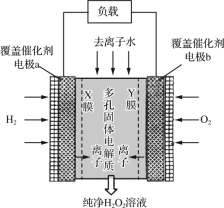
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H>0
B.常温下,等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.常温下,0.1mol•L﹣1CH3COONa溶液加水稀释后,溶液中
的值增大
D.常温下,向BaCO3、BaSO4的饱和溶液中加入少量BaCl2固体,溶液中
减小
难度: 中等查看答案及解析
-
铁杉脂素是重要的木脂素类化合物,其结构简式如图所示。下列有关铁杉脂素的说法正确的是( )
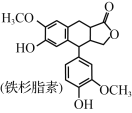
A.分子中有3个手性碳原子
B.能与甲醛发生缩聚反应
C.分子中所有的碳原子可能处于同一平面
D.1mol铁杉脂素与NaOH溶液反应最多消耗4molNaOH
难度: 中等查看答案及解析
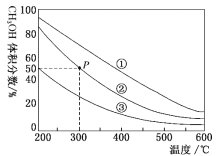
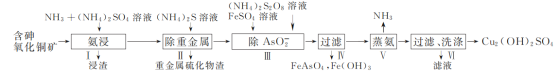
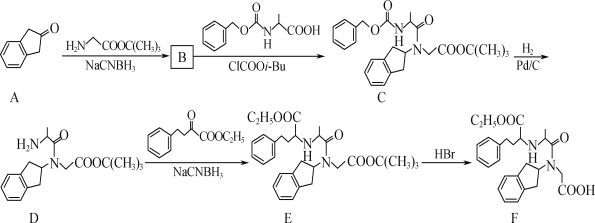
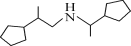 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。