-
2019年10月1日,在北京天安门广场举行了盛大的阅兵式。以下有关“阅兵式上的化学”说法错误的是
A.为保证安全,阅兵式上放飞的气球中充灌的是比氢气稍重的氦气
B.用以加工拉烟剂的柴油、润滑油、豆油等原料均属于烃类物质
C.“歼-20”飞机上大量使用的碳纤维是一种新型无机非金属材料
D.军车、坦克上喷涂的聚氨酯迷彩涂料属于有机高分子材料
难度: 中等查看答案及解析
-
下列关于有机化合物杜瓦苯(
)的说法中错误的是
A.杜瓦苯与苯互为同分异构体
B.杜瓦苯的二氯代物共有六种(不含立体异构)
C.杜瓦苯中所有的碳原子可能共平面
D.杜瓦苯可使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
中学化学中常见的四种元素W、X、Y、Z原子序数依次增大。已知W的一种单质可供人类呼吸;X是地壳中含量最多的金属元素;含Y元素的一种盐的水溶液可用于新冠病毒的防护消毒;Y与Z形成的一种盐的溶液常用作铜制电路板的刻蚀液。下列叙述正确的是
A.W、X、Y、Z均属于短周期元素 B.简单离子的半径:X>Y>W
C.含X元素的盐溶液一定呈酸性 D.W、Y的单质均能支持氢气燃烧
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol14C中含有的中子数为0.8NA
B.4.6gC2H5OH中含有的共价键数目为0.7NA
C.24gO3与11.2LO2所含的分子数均为0.5NA
D.常温下pH=3的醋酸溶液中,OH-数目为10-11NA
难度: 中等查看答案及解析
-
下列实验设计能达到实验目的的是
选项
实验目的
实验设计
A
制备NH4Cl晶体
将NH4Cl饱和溶液蒸干
B
证明溶液中含有Fe2+
向溶液中依次滴加新制氯水和KSCN溶液
C
比较Al和Al2O3熔点的高低
将铝箔在酒精灯上加热至熔化,轻轻晃动
D
验证SO2具有漂白性
将SO2通入滴有酚酞的NaOH溶液中,红色褪去
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
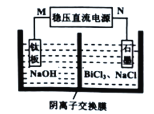
近年来,随着工业、科技的迅速发展,氢气的用途越来越广,对氢气纯度的要求也越来越高,高纯氢的制备成为热点。利用太阳能光伏电池电解水制高纯氢的工作示意图如下,该装置通过控制开关连接K1或K2,可交替得到H2和O2,下列叙述不正确的是

A.开关连接K1时,“电极1”一端产生氢气
B.产生氧气的电极反应为:4OH--4e-=2H2O+O2↑
C.开关连接K1或K2时,“电极3”上NiOOH和Ni(OH)2相互转化,实现循环使用
D.开关与K1相连时,“电极3”的反应为:Ni(OH)2+OH-+e-=NiOOH+H2O
难度: 中等查看答案及解析
-
常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)⇌ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
难度: 中等查看答案及解析
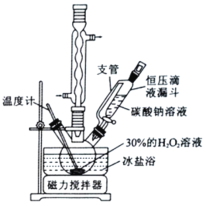
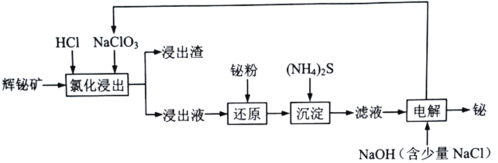
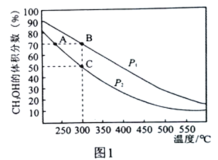
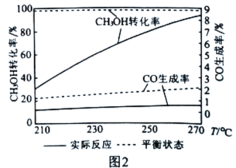
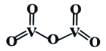
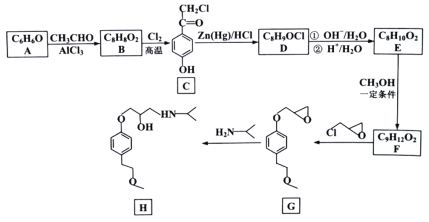
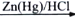 CH3CH2CH2R
CH3CH2CH2R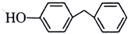 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:___________________(无机试剂任选)。