-
《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是
A. “薪柴之灰”可与铵态氮肥混合施用 B. “以灰淋汁”的操作是萃取
C. “取碱”得到的是一种碱溶液 D. “浣衣”过程有化学变化
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.电解精炼铜时,若转移了NA个电子,则阳极溶解32 g铜
B.标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4 mol Cl2转移的电子数为8NA
D.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
难度: 简单查看答案及解析
-
下列有关有机化合物的说法正确的是
A. 糖类、油脂、蛋白质都是仅由碳、氢、氧元素组成的物质
B. 甲烷光照条件下能与Cl2发生加成反应
C. 分枝酸的结构简式为
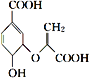 ,分枝酸可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,分枝酸可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色D. 甲基环己烷的一氯代物有4种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加,W的原子中只有1个电子,X2-和Y+ 离子的电子层结构相同,X与Z同族。下列叙述正确的是
A. 原子半径:Z > Y > W
B. X 的简单氢化物的稳定性比Z的弱
C. Y的氢化物为共价化合物
D. Z的最高价氧化物对应的水化物是一种强酸
难度: 中等查看答案及解析
-
探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
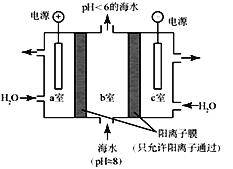
下列说法不正确的是
A. a室中OH-在电极板上被氧化
B. b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D. 若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2 + 2OH- - 2e- =2H2O
难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示,下列说法中,正确的是
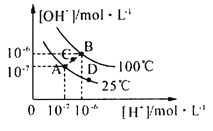
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
难度: 中等查看答案及解析
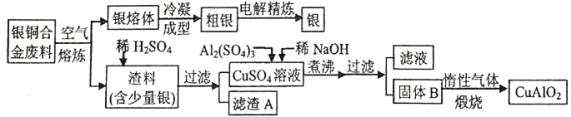
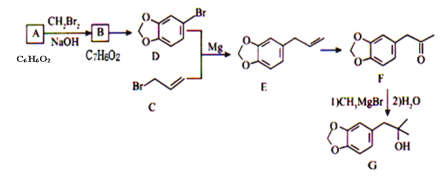
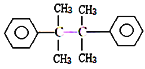 的合成路线________。
的合成路线________。