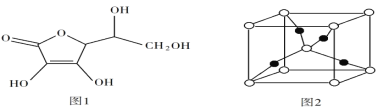-
下列大小关系比较正确的是
A.离子半径:F-<Na+<Mg2+ B.电负性:C<O<N
C.氢化物的沸点:NH3<PH3<AsH3 D.碱性: NaOH)>Mg(OH)2> Al(OH)3
难度: 简单查看答案及解析
-
正丁烷与异丁烷互为同分异构体的依据是
A.具有相似的物理性质
B.具有相似的化学性质
C.具有不同的分子结构
D.分子式相同,但分子内碳原子的连接方式不同
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.CH2F2的电子式:
B.羟基的电子式:
C.对硝基甲苯的结构简式:
D.异丙醇的结构简式:CH3CH2CH2OH
难度: 中等查看答案及解析
-
下列有关工业生产叙述正确的是
A.工业上通常使用电解法制备金属钠、镁、铝等
B.合成氨工业中,将NH3及时液化分离有利于加快反应速率
C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D.电解精炼铜时,将粗铜与电源的负极相连
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.0.1 mol溴苯中含有双键的数目为0.3NA
B.标准状况下,22.4 L己烷中含己烷分子数目为NA
C.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
D.1mol甲醇中含有C—H键的数目为4NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明溶液中:Cl-、NO3-、Cu2+、NH4+
B.水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu 2+、SO42-、NO3-、Cl-
C.中性溶液中:Fe3+、Al3+、NO3-、SO42-
D.能使苯酚变紫色的溶液:K+、Mg2+、S2-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A.①②③④ B.②③④ C.③④ D.②④
难度: 中等查看答案及解析
-
0.01mol氯化铬(CrCl3· 6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此氯化铬最可能是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O D.[Cr(H2O)3Cl3]·3H2O
难度: 中等查看答案及解析
-
下列说法正确的是
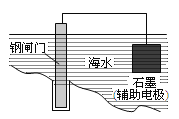
A.用酸性KMnO4溶液能鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
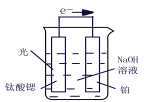
B.用图所示方法可保护钢闸门不被腐蚀
C.根据核磁共振氢谱不能鉴别1溴丙烷和2溴丙烷
D.食用花生油和鸡蛋清都能发生水解反应
难度: 中等查看答案及解析
-
短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,X原子最外层电子数比次外层电子数少3,下列说法正确的是
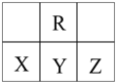
A.X的气态氢化物比R的气态氢化物稳定
B.原子半径大小顺序是:r(Z)> r( Y) > r( X)
C.Y、R形成的化合物YR2能使酸性KMnO4溶液褪色
D.X、Z形成的化合物XZ5中各原子均满足最外层8电子结构
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。Y是地壳中含量最高的元素,X、Y原子的最外层电子数之比为2:3,Z是短周期中金属性最强的元素,W原子与X原子的最外层电子数相同。下列说法正确的是
A. Z位于元素周期表中第2周期ⅠA族
B. X的非金属性比Y的强
C. W的简单气态氢化物的热稳定性比X的强
D. 原子半径:r(Y) < r(X) < r(W) < r(Z)
难度: 中等查看答案及解析
-
已知Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/ c(CO32-) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6mol·L-1
难度: 中等查看答案及解析
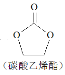 +H2O
+H2O