-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列由实验现象得出的结论正确的是
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)< Ksp(AgI)
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br—还原性强于Cl—
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
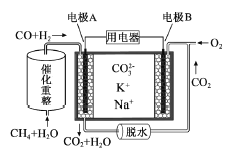
A.反应
,每消耗1mol CH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g) 达到平衡。下列说法正确的是
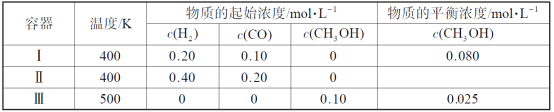
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
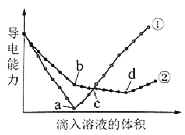
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
难度: 中等查看答案及解析
-
实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
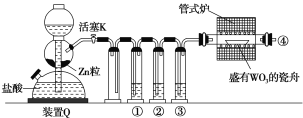
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
难度: 中等查看答案及解析
-
某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
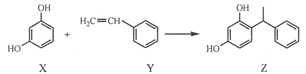
下列叙述错误的是
A.X、Y和Z均能使溴水褪色
B.X和Z均能与NaHCO3溶液反应放出CO2
C.Y既能发生取代反应,也能发生加成反应
D.Y可作加聚反应单体,X可作缩聚反应单体
难度: 中等查看答案及解析

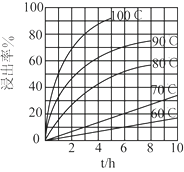
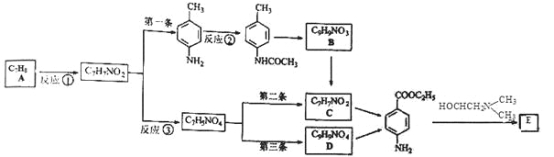
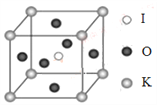 .
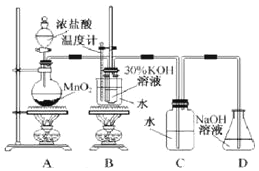
.
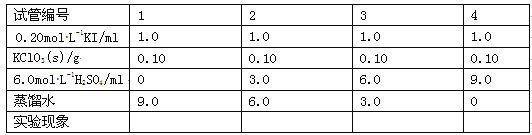
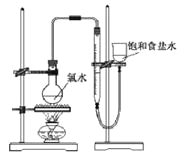
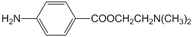 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):