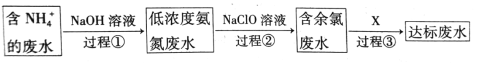
-
肺炎疫情牵动着每一个人的心,大家出行务必戴好口罩,保护好自己。下列相关说法错误的是
A.医用消毒酒精中乙醇的体积分数约为75%
B.居家环境消毒时,不可将“84”消毒液、洁厕灵混合使用
C.人打喷嚏时产生的飞沫(直径>5μm的含水颗粒)属于气溶胶
D.向空气中喷洒大量酒精进行消毒,存在安全隐患
难度: 简单查看答案及解析
-
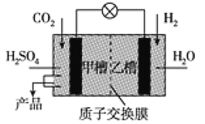
反应Cl2+H2O ⇌HCl+HClO可用于自来水消毒。下列表示反应中相关微粒的化学用语正确的是
A.HClO结构式:H—Cl—O B.Cl-的结构示意图:
C.HCl电子式:
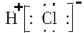 D.中子数为18的氯原子
D.中子数为18的氯原子难度: 简单查看答案及解析
-
“玉兔”号月球车用
作为热源材料,下列关于
的说法正确的是( )
A.
与
互为同位素 B.
与
互为同素异形体
C.
与
具有完全相同的化学性质 D.
与
具有相同的最外层电子
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.2.0g H218O与D216O的混合物中所含中子数为NA
B.1 mol Na2O2固体中含离子总数为4NA
C.标准状况下,11.2L CCl4中含有分子的数目为0.5 NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
B.碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3−+OH−=CaCO3↓+H2O
C.硫酸与氢氧化钡溶液反应:H++ SO42-+Ba2++OH−=BaSO4↓+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++ SO42-+Ba2++2OH−=BaSO4↓+Cu(OH)2↓
难度: 中等查看答案及解析
-
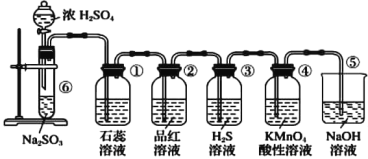
下列实验操作能达到实验目的的是
选项
试剂
实验目的
实验装置
X
Y
Z
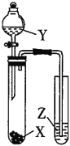
A
MnO2
浓盐酸
KI-淀粉溶液
比较Cl2与I2的氧化性强弱
B
石灰石
浓盐酸
Na2SiO3溶液
C元素非金属性大于Si元素
C
蔗糖
浓硫酸
溴水
证明浓硫酸具有脱水性、氧化性
D
Na2SO3
稀HNO3
品红溶液
证明SO2具有漂白性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质中:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al含有共价键的离子化合物是
A.①③⑤⑥ B.③⑤⑥
C.②④⑦ D.①③④⑤⑥⑦
难度: 简单查看答案及解析
-
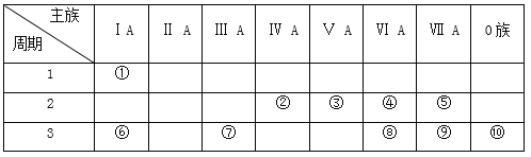
a、b、c、d是短周期元素,在周期表中的相对位置如图所示,d元素原子核外M层电子数是K层电子数的2倍。下列说法中,错误的是( )
A. 高温下,a单质可与d的氧化物发生置换反应
B. b的气态氢化物可与其最高价含氧酸反应
C. a、b、c 的最高正化合价等于其所在族序数
D. d的氧化物是制作光导纤维的材料
难度: 中等查看答案及解析
-
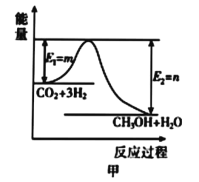
关于如图的说法不正确的是( )
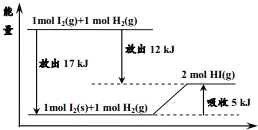
A. 1mol固态碘与1mol氢气化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与1mol氢气时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与氢气生成HI气体的反应是吸热反应
难度: 简单查看答案及解析
-
下列变化中:①碘升华;②NaCl固体溶于水;③O2溶于水;④HCl气体溶于水;⑤烧碱融化;⑥硫酸溶于水;⑦蔗糖溶于水;⑧HI分解,仅共价键被破坏的是
A.①③⑤ B.②③⑦ C.②④⑥ D.④⑥⑧
难度: 简单查看答案及解析
-
反应 A + 3B
2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
A.(2)>(4)>(3)>(1) B.(1)>(4)>(2)= (3)
C.(4)>(3)=(2)>(1) D.(2)>(3)= (4)>(1)
难度: 简单查看答案及解析
-
如图是可逆反应:X2(g)+3Y2(g) ⇌2Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
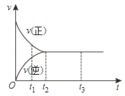
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
难度: 简单查看答案及解析
-
已知:4HCl(g)+O2(g)⇌2Cl2(g)+ 2H2O(g),该反应放出123kJ/mol的热量。其中相关的化学键键能数据如下:其中a的值为
化学键
H—Cl
O=O
Cl—Cl
H—O
E/(kJ/mol)
431
497
a
465
A.242 B.303.5 C.180.5 D.365
难度: 简单查看答案及解析
-
下列叙述正确的是
A.SO2的催化氧化是放热反应,温度升高,反应速率减慢
B.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5% H2O2和1 mL H2O,向另一支试管中加入2mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.反应C(s)+H2O(g)⇌CO(g)+H2(g),保持体积不变,充入氦气使体系的压强增大,可以增大其化学反应速率
难度: 简单查看答案及解析
-
一种铁-空气二次电池放电时氧原子的工作原理如图所示,电池反应为2Fe+O2+2H2O=2Fe(OH)2。下列有关该电池放电时的说法正确的是
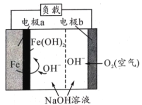
A.能量由电能转变为化学能
B.电池工作时OH-由a极迁移向b极
C.b 极电极反应式为O2+4e-+4H+=2H2O
D.电子由a极经负载流向b
难度: 简单查看答案及解析
-
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
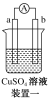
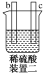
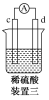
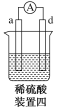
部分实验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述转化关系如图所示。下列说法正确的是
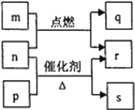
A.q与s均为酸性氧化物 B.原子半径:W<Y<X
C.非金属性:W<Y< X D.Z的含氧酸一定是强酸
难度: 中等查看答案及解析
-
实验室可用下图装置制取少量氮气。下列说法正确的是
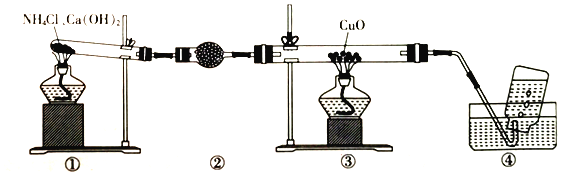
A.②中盛放的是五氧化二磷
B.实验开始时先点燃③的酒精灯,再点燃①的酒精灯
C.③中玻璃管中的反应:2NH3+3CuO
N2+3Cu+3H2O
D.实验结束时先熄灭①、③的酒精灯,再将导管从水槽中拿出
难度: 中等查看答案及解析