-
下列关于碱金属元素和卤素的说法中,错误的是( )
A. 钾与水的反应比钠与水的反应更剧烈
B. 随核电荷数的增加,卤素单质的颜色逐渐变浅
C. 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
D. 碱金属元素中,锂原子失去最外层电子的能力最弱
难度: 中等查看答案及解析
-
雷雨天闪电时空气中有臭氧(O3)生成。下列说法正确的是()
A. O2和O3互为同位素
B. O2和O3的相互转化是物理变化
C. 在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D. 等物质的量的O2和O3含有相同的质子数
难度: 简单查看答案及解析
-
对于下列事实的解释正确的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
目前我国许多城市定期公布空气质量报告,在空气质量报告中,一般不涉及( )
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
难度: 简单查看答案及解析
-
下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D.F-
难度: 简单查看答案及解析
-
下列气体既可以用浓硫酸干燥,又可以用碱石灰干燥的是( )
A.SO2 B.NH3 C.H2S D.O2
难度: 简单查看答案及解析
-
下列元素中,最高正化合价数值最大的是( )
A.N B.O C.F D.Al
难度: 简单查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是( )
A.碘升华 B.Cl2溶于水 C.氯化钠受热熔化 D.冰融化成水
难度: 中等查看答案及解析
-
下列各组化合物中,化学键类型完全相同的时( )
A.CaCl2和Na2S B.Na2O和Na2O2 C.CO2和CaO D.HCl和NaOH
难度: 简单查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法正确是( )
A.工业上利用合成氨实现人工固氮涉及氧化还原反应
B.CO、SO2、NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在
C.光化学烟雾的形成主要与NOx、SO2和碳氢化合物有关
D.大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨
难度: 中等查看答案及解析
-
某元素最高正价与最低负价的绝对值之差为4,该元素的离子与跟其核外电子排布相同的离子形成的化合物是( )
A.K2S B.MgO C.MgS D.NaF
难度: 中等查看答案及解析
-
X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( )
A.HX B.H2X C.XH3 D.XH4
难度: 中等查看答案及解析
-
下列关于SO2性质的说法正确的是( )
A.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
B.氯气和二氧化硫都有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色布条,可以观察到有色布条先褪色,后复原
C.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,该白色沉淀是BaSO3
D.向SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有还原性
难度: 中等查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.含有离子键的化合物一定是离子化合物
B.只由非金属元素形成的化合物可能不是共价化合物
C.非极性键也可能存在于离子化合物中
D.含有共价键的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列有关描述一定是主族元素的是( )
A.原子最外层电子数是2
B.某原子M层上电子数等于其L层上电子数
C.原子最外层电子数是3
D.L层上电子数是偶数
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
难度: 简单查看答案及解析
-
下列化学用语不正确的是( )
A.次氯酸的结构式:H-O-Cl
B.CO2的电子式:
C.H2O2的电子式:

D.NaCl的形成过程为:

难度: 中等查看答案及解析
-
为了验证浓硫酸和木炭粉在加热条件下产生的产物,某同学选用了如图所示的实验装置。下列说法错误的是( )

A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.F装置用来检验产物中是否有CO2生成
D.将装置B与C位置互换,仍可以达到实验目的
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
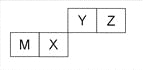
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第二周期、第ⅥA族
难度: 中等查看答案及解析
-
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.
三种元素形成的化合物中一定只含共价键
C.由元素
组成的某种化合物可与
反应生成
D.元素A与
形成的常见化合物中,热稳定性最好的是AD
难度: 中等查看答案及解析
-
1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mL B. 336mL C. 224mL D. 168mL
难度: 中等查看答案及解析
