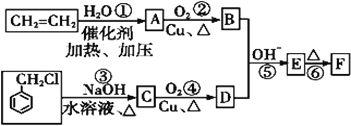
-
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法不正确的是( )
A.可回收的易拉罐中含金属铝,可通过电解熔融氯化铝制取
B.侯氏制碱法工艺流程中利用了物质溶解度的差异
C.废旧电池中含有镍、镉等重金属,不能用填埋法处理
D.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.l mol/L Na2CO3溶液中,阴离子总数小于NA
B.常温下,10 mL pH=1的醋酸溶液中含有的氢离子数大于0.001NA
C.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
D.相同体积、相同物质的量浓度的CH3COONa溶液和NaCl溶液所含离子数目相同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、SO42-、F-
B.滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C.滴入甲基橙变黄色的溶液:NH4+、Fe3+、ClO-、SO42-
D.0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列根据实验操作、现象得出相应结论一定正确的是
选项
实验操作、现象
实验结论
A
用pH计测定同浓度NaF溶液和CH3COONa溶液:
pH(NaF)<pH(CH3COONa)
酸性:HF>CH3COOH
B
向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅
c(KCl)增大使该反应
FeCl3+3KSCN
Fe(SCN)3+3KCl
的化学平衡逆向移动
C
向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀
KSP(AgCl)>KSP(AgI)
D
将10mL 2mol/L FeCl3的溶液与1 mL 1mol/L KI溶液混合充分反应后滴加KSCN,溶液颜色变红
KI与FeCl3反应有可逆性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )

A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如表所示
弱酸
CH3COOH
HClO
H2CO3
H2SO3
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是( )
A.CO2+H2O +2C1O- =CO32-+2HClO B.2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O
C.SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO D.SO2+CO32-=CO2+SO32-
难度: 中等查看答案及解析
-
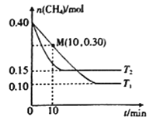
25 ℃时,分别向20.00 mL 0.100 0 mol·L-1的氨水、醋酸铵溶液中滴加0.100 0 mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是( )
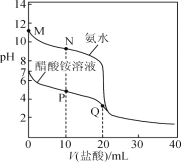
A.M点溶液中:c(OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B.N点溶液中:c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
C.P点溶液中: c(NH4+)+c(NH3·H2O)<c(CH3COO-) +c(CH3COOH)
D.Q点溶液中:2c(Cl-)=c(CH3COOH)+c(NH4+)
难度: 中等查看答案及解析