-
在抗击“2019新型冠状病毒”的过程中,大量防护和消毒用品投入使用。下列有关说法正确的是( )
A.新型冠状病毒由C、H、O三种元素组成
B.二氧化氯泡腾片和酒精均可杀灭新型冠状病毒,二者的消毒原理相同
C.聚丙烯和聚四氟乙烯为生产防护服的主要材料,二者均属于有机高分子材料
D.84消毒液是以NaClO为主要有效成分的消毒液,与医用酒精混合可以提升消毒效果
难度: 中等查看答案及解析
-
用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
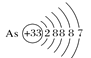
A.砷原子的结构示意图
 B.BF4—的结构式
B.BF4—的结构式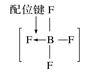
C.HF分子间的氢键
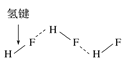 D.丙氨酸的手性异构
D.丙氨酸的手性异构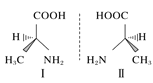
难度: 中等查看答案及解析
-
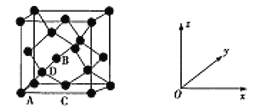
下列关于晶体说法正确的是( )
A.金属晶体的熔沸点均高于分子晶体
B.含有阳离子的晶体一定是离子晶体
C.SiO2一定具有多面体外形
D.金属导电和熔融电解质(或电解质溶液)导电的原理不一样
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子的稳定性与分子间作用力无关
B.键长等于成键两原子的半径之和
C.分子中中心原子若采用sp3杂化轨道成键,则该分子一定为正四面体结构
D.可燃冰(CH4·nH2O)中甲烷分子与水分子之间形成了氢键
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C.某基态原子的核外电子排布图为
 ,它违背了泡利原理
,它违背了泡利原理D.某价电子排布为3d14s2的基态原子,该元素位于周期表中第四周期第ⅢB族
难度: 中等查看答案及解析
-
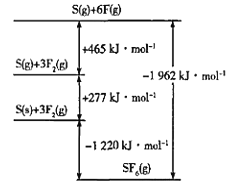
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰晶体中氢键的数目为4NA
B.干冰晶胞熔化时,1mol干冰要断裂2mol碳氧双键
C.1mol氯化钠中含有NA个离子键
D.在含2molSi-O键的SiO2晶体中,氧原子有2NA个
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.稳定性:HF<HCl<HBr<HI
B.沸点:H2O>HF>NH3
C.熔点:晶体Si>金刚石>SiCl4
D.阴离子的配位数:CsCl<NaCl<CaF2
难度: 中等查看答案及解析
-
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A.AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B.AlF3晶体的晶格能小于NaCl晶体的晶格能
C.同族元素的氧化物可以形成不同类型的晶体
D.不同族元素的氯化物可以形成相同类型的晶体
难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①冰的密度比液态水的密度小;②NH3的稳定性比第VA族其他元素的氢化物的高;③尿素的熔沸点比醋酸的高;④水分子在高温下也很稳定;⑤小分子的羧酸、醇可以和水以任意比例互溶;⑥邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低
A.①②③④ B.①③④⑤ C.①③⑤⑥ D.②③⑤⑥
难度: 中等查看答案及解析
-
下列关于酸性强弱比较正确的是( )
A.HClO<HBrO B.HClO2<HClO
C.H2SO4<H3PO4 D.H2SO3<H2SO4
难度: 中等查看答案及解析
-
已知信息:[Cu(NH3)4]SO4的电离方程式为[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。具有6个配体的Co3+的配合物CoClm·nNH3,若1mol此配合物与足量的AgNO3溶液反应只生成1molAgCl沉淀,则m、n分别是( )
A.m=1,n=5 B.m=3,n=3 C.m=3,n=4 D.m=5,n=1
难度: 中等查看答案及解析
-
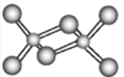
根据图中相关信息,判断下列说法正确的是( )
A.在NaCl晶体中,距离Na+最近的Cl-形成正四面体
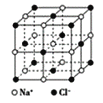
B.该气态团簇分子的分子式为E4F4或F4E4
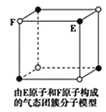
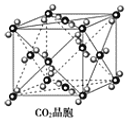
C.CO2晶胞中每个分子周围有8个紧邻的CO2分子
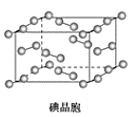
D.在碘晶体中,碘分子的排列有4种不同的方向
难度: 中等查看答案及解析
-
下表是第三周期部分元素的电离能数据,下列说法正确的是( )

A.甲的金属性比乙弱 B.乙的最高正化合价为+1
C.丙一定为非金属元素 D.丁一定是金属元素
难度: 中等查看答案及解析
-
下列实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
除去NaCl中的Na2CO3
先将混合物加水溶解,再加入过量CaCl2溶液,充分反应后过滤,最后蒸发结晶得到纯NaCl
B
鉴别二氧化硫和乙烯
将二氧化硫和乙烯分别通入足量澄清石灰水中,能使澄清石灰水变浑浊的是二氧化硫
C
比较铁和铜的金属性强弱
常温下,将铁片、铜片、导线、浓硝酸组成原电池,铁片表面产生气泡,铜片溶解
D
证明氧化性:Cl2>Fe3+
将Cl2通入Fe(NO3)2溶液中,溶液由浅绿色变为棕黄色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图所示为二维平面晶体示意图,所表示的化学式为AX3的是( )
A.
 B.
B. C.
C. D.
D.
难度: 中等查看答案及解析
-
已知某化合物的晶体是由如图所示的最小结构单元密置堆积而成,下列关于该化合物叙述错误的是( )

A.该化合物的化学式是YBa2Cu3O6
B.1mol该化合物中含有1molY
C.1mol该化合物中含有3molCu
D.1mol该化合物中含有2molBa
难度: 中等查看答案及解析