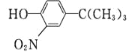
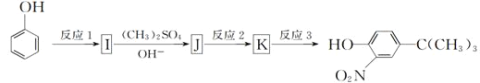
-
化学与生活、环境、科技等密切相关。下列说法错误的是
A.温室效应导致海水的酸度增大,贝壳类生物的生存将会受到威胁
B.植物油的主要成分是不饱和高级脂肪酸甘油酯,长时间放置的植物油会因水解而变质
C.常温下用3体积乙醇与1体积蒸馏水配制成的混合液,可以灭活新型冠状病毒
D.白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被氧化
难度: 简单查看答案及解析
-
现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )
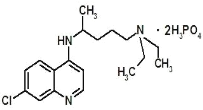
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,则下列说法不正确的是
A. 23g 钠在空气中充分燃烧,转移的电子数为NA
B. 50ml 12mol/L的盐酸与足量的MnO2共热,充分反应后,转移电子数为0.3NA
C. 0.6mol过氧化钠晶体中所含阴离子的数目为0.6NA
D. 常温常压下,8.8gN2O 和CO2混合气体所含的原子总数为0.6NA
难度: 中等查看答案及解析
-
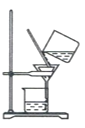
图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
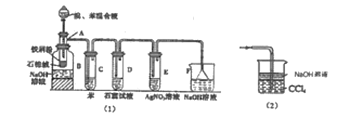
A.苯和液溴在A中发生反应的化学方程式为:
+Br2
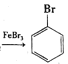 +HBr
+HBrB.实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C.D、E、F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D.D中石蕊试液慢慢变红,E中产生浅黄色沉淀
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中。常温下Z单质能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )
A.最简单氢化物的沸点:Y>W
B.元素Y的最高化合价为+6价
C.原子半径的大小顺序:W>Z>X>Y
D.X、Z、W分别与Y均能形成多种二元化合物
难度: 中等查看答案及解析
-
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是( )
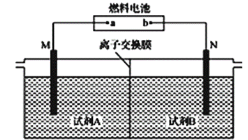
A.b电极的反应式为CH3OCH3+3H2O-12e-=2CO2↑+12H+
B.试剂A为饱和食盐水,试剂B为NaOH稀溶液
C.阴极生成1mol气体时,理论上导线中流过2mole-
D.阳极生成1mol气体时,有1mol离子通过离子交换膜
难度: 中等查看答案及解析
-
室温下,用0.100mol·L−1的NaOH溶液分别滴定均为20.00mL0.100mol·L−1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
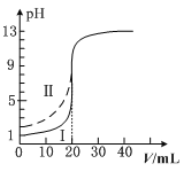
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
 B.
B. 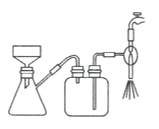 C.
C. 
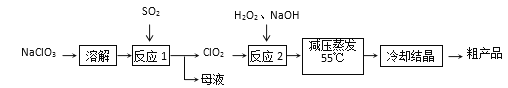
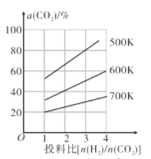
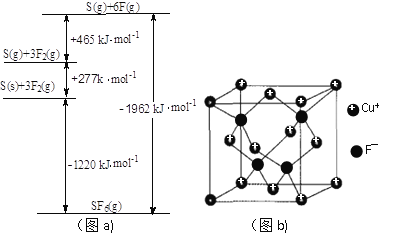
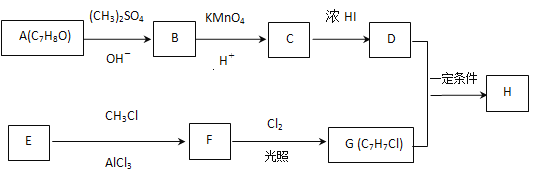
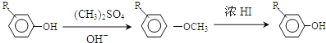 ;
;