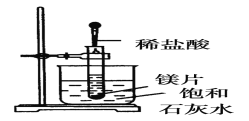
-
下列关于氮的氧化物的说法中,正确的是
A. 氮的氧化物都是酸性氧化物
B. 氮的氧化物都既有氧化性,又有还原性
C. NO2 与 H2O 反应生成 HNO3,所以 NO2 是酸性氧化物
D. NO 和 NO2 均有毒
难度: 简单查看答案及解析
-
下列关于元素周期表的说法正确的是
A.第 IA 族的所有元素都是金属元素
B.同周期主族元素中,第ⅦA 族元素原子半径最小
C.稀有气体元素原子的最外层电子数均为 8
D.元素周期表共有 7 个周期,18 个族
难度: 中等查看答案及解析
-
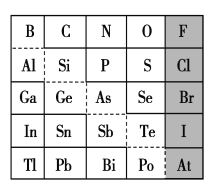
下列各组中,属同一主族的是 ( )
A.Mg、Be、Ca B.O、As、S C.N、P、Se D.F、I、Ar
难度: 中等查看答案及解析
-
元素周期表里金属元素和非金属元素分界线附近能找到( )
A.新制农药元素 B.制催化剂元素
C.制半导体元素 D.制耐高温合金元素
难度: 简单查看答案及解析
-
元素性质呈周期性变化的原因是( )
A.原子量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素化合价呈周期性变化
难度: 简单查看答案及解析
-
下列关于硝酸的认识中,正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.浓硝酸与金属反应不放氢气,而稀硝酸与金属反应可置换出氢气
C.因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中
D.硝酸与金属反应时,只表现出氧化性
难度: 简单查看答案及解析
-
关于原子结构的叙述正确的是
A.所有的原子核都是由质子和中子组成的 B.原子的最外层电子数不超过8个
C.稀有气体原子的最外层电子数均为8 D.原子的次外层电子数都是2
难度: 简单查看答案及解析
-
下列有关化学反应过程或实验现象的叙述中,正确的是( )
A.氯气的水溶液可以导电,说明氯气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D.氯水中加入有色布条,布条褪色,说明溶液中有Cl2存在
难度: 中等查看答案及解析
-
X、Y、Z、Q、W均为短周期主族元素,原子序数依次增大,X、Y是组成空气的主要元素,Y2-与Z+核外电子排布相同,Q的原子序数为Y的2倍。下列说法正确的是
A.X、Y组成的原子个数比为1:1和1:2的两种化合物均是共价化合物
B.Y和Z可组成阴阳离子个数比为1:1和1:2的两种物质
C.Y、Q的简单氢化物的热稳定性:Q>Y
D.X、Q、W最高价氧化物对应的水化物的酸性:X>W>Q
难度: 中等查看答案及解析
-
下列元素中,原子半径最大的是
A.Li B.Na C.F D.Cl
难度: 简单查看答案及解析
-
下列递变规律正确的是( )
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.HF、HCl、H2S、PH3的稳定性依次增强
D.KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强
难度: 中等查看答案及解析
-
据报道,氢燃料电池公交汽车已经驶上北京街头,下列说法中,正确的是
A. 电解水制取氢气是理想而经济的制氢方法
B. 发展氢燃料电池汽车不需要安全高效的储氢技术
C. 氢燃料电池汽车的使用可以有效减少城市空气污染
D. 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.化学能可以转变成为热能、电能等
B.化学反应必然伴随发生能量变化
C.化学反应中的能量变化主要是由化学键的变化引起的
D.化学反应中能量变化的多少与反应物的质量无关
难度: 简单查看答案及解析
-
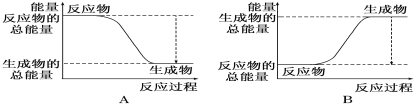
从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
难度: 简单查看答案及解析
-
Ce是地壳中含量最高的稀土金属元素,下列关于
的说法正确的是
A.质子数为82 B.质量数为198
C.中子数为140 D.核外电子数为58
难度: 简单查看答案及解析
-
某元素的最高价氧化物对应的水化物的分子式是H4RO4,则其氢化物的分子式是( )
A.RH3 B.H2R C.RH4 D.HR
难度: 简单查看答案及解析
-
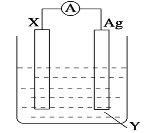
能证明NaCl是离子化合物的事实是
A.常温下是固体 B.熔融态能导电 C.水溶液能导电 D.易溶于水
难度: 简单查看答案及解析
-
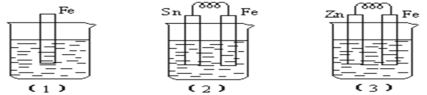
下列装置能构成原电池的是( )
A.
 B.
B.
C.
 D.
D.
难度: 简单查看答案及解析
-
下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.
可由两种单质直接反应生成,将其加入
溶液中同时有气体和沉淀产生
D.除去
中混有的
可加入适量的稀盐酸
难度: 简单查看答案及解析
-
如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
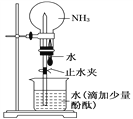
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
难度: 简单查看答案及解析
-
下列有关浓H2SO4的叙述中,正确的是( )
A.浓H2SO4与铜片共热的反应中,浓H2SO4既表现出强氧化性,又表现出酸性
B.浓H2SO4与金属活动性顺序中氢后面的金属反应生成的气体一般为H2
C.常温下,铁或铝不与浓H2SO4反应,所以可用铁或铝制的容器贮存浓H2SO4
D.浓H2SO4是不挥发性强酸,氢硫酸是挥发性弱酸,所以可用浓H2SO4与FeS反应制取H2S气体
难度: 简单查看答案及解析