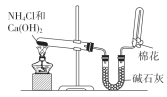
-
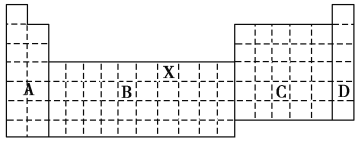
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
难度: 简单查看答案及解析
-
下列关于元素周期表应用的说法正确的是( )
A.在过渡元素中,可以找到半导体材料
B.在ⅠA、ⅡA族元素中,寻找制造农药的主要元素
C.在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
D.为元素性质的系统研究提供指导,为新元素的发现提供线索
难度: 简单查看答案及解析
-
你认为减少酸雨产生可采用的措施是( )
①少用煤作燃料 ②把工厂烟囱加高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
难度: 简单查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.硅胶可作袋装食品的干燥剂
B.漂白粉在空气中很稳定
C.生石灰能与水反应,可用来干燥氯气
D.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
难度: 简单查看答案及解析
-
下列表示物质的化学用语正确的是( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:H+[
]-
C.Cl-离子的结构示意图:
D.CO2的结构式:O=C=O
难度: 简单查看答案及解析
-
下列物质中,只含有一种类型化学键的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 简单查看答案及解析
-
核电荷数大于10的某短周期元素,其原子最外电子层所含有的电子数是次外层所含有的电子数的一半,有关该元素的单质或化合物的描述不正确的是( )
A.该元素在第三周期第ⅣA族
B.该元素的单质在常温下性质稳定,不易与水反应
C.该元素的氧化物不与酸反应,可与强碱的水溶液反应
D.该元素在地壳中的含量大,居所有元素的第二位
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.同周期主族元素的原子半径以ⅦA族的为最大
B.同主族两种元素原子的核外电子数的差值可能为32
C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素
D.科学家在周期表中金属与非金属分界线处找到了优良的催化剂
难度: 简单查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是( )
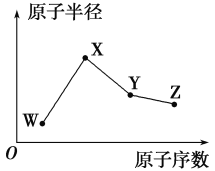
A.对应气态氢化物的稳定性:Y>W
B.对应简单离子的半径:W>Z
C.化合物XZW中既含离子键也含共价键
D.Y的氧化物能与Z的最高价氧化物对应的水化物反应
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.
与
得电子能力相同
难度: 简单查看答案及解析
-
长征火箭承担运载“天宫”号的使命。氕化锂、氘化锂、氚化锂可以作为启动长征火箭发射的优良燃料。下列说法中正确的是( )
A.LiH、LiD、LiT的核外电子数之比为1:2:3
B.它们都是强氧化剂
C.H、D、T是相同元素构成的不同单质
D.它们都是强还原剂
难度: 中等查看答案及解析
-
最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是( )
A.是氢的一种新的同素异形体
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比一个普通H2分子多一个氢原子核
难度: 中等查看答案及解析
-
2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用
Ca轰击
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A.第117号元素是副族元素 B.
Bk的质量数为97
C.第117号元素是非金属元素 D.
Ca2+的中子数比核外电子数多10
难度: 简单查看答案及解析
-
已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,下列关于A、B、C、D四种元素的叙述正确的是( )
A.原子半径:A>B>C>D B.原子序数:b>a>c>d
C.离子半径:D>C>B>A D.金属性:B>A,非金属性:D>C
难度: 简单查看答案及解析
-
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
A.浓硫酸与水 B.生石灰与水
C.熟石灰与水 D.氯化钠与水
难度: 简单查看答案及解析
-
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
难度: 简单查看答案及解析
-
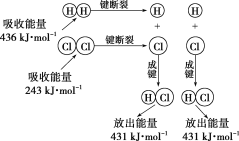
环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O2
3CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1molC3H8和5molO2所具有的总能量大于3molCO2和4molH2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
难度: 中等查看答案及解析
-
如图表示吸收能量的反应的图像是( )
A.
 B.
B.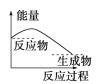
C.
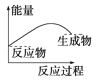 D.
D.
难度: 简单查看答案及解析