-
化学与生活密切相关,下列观点错误的是( )
A.硝酸铵、液氨可用作制冷剂
B.苏打、小苏打可用作食用面碱
C.二氧化氯、漂白粉可用作自来水的杀菌消毒剂
D.氧化铝、二氧化硅可用作制坩埚
难度: 简单查看答案及解析
-
BASF高压法制备醋酸,所采用钴碘催化循环过程如图所示,则下列观点错误的是( )
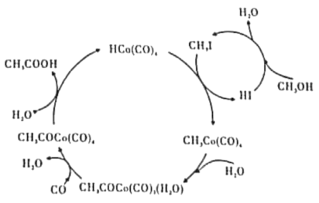
A.CH3OH转化为CH3I的有机反应类型属于取代反应
B.从总反应看,循环过程中需不断补充CH3OH、H2O、CO等
C.与乙酸乙酯互为同分异构体且与CH3COOH互为同系物的物质有2种结构
D.工业上以淀粉为原料也可以制备醋酸
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.52g苯乙烯含碳碳双键数目为2NA
B.1L0.5mol·L-1醋酸钠溶液中阴阳离子总数目小于NA
C.标准状况下,22.4L一氯甲烷含共用电子对数为4NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
难度: 中等查看答案及解析
-
已知A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中B和D同主族,中学阶段常见物质X、Y、Z为其中的三种元素组成的化合物,且均为强电解质,当X、Y按物质的量之比为1:2反应时,有如图转化关系。下列说法正确的是( )

A.C、D、E三种元素一定位于同一周期
B.物质X、Y、Z既含有离子键又含有共价键
C.C和D形成的化合物溶于水,其溶液显中性
D.简单氢化物的热稳定性:D>E
难度: 困难查看答案及解析
-
次磷酸钴[Co(H2PO2)2]广泛应用于化学电镀,工业上利用电渗析法制取次磷酸钴的原理图如图所示。
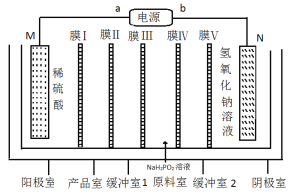
已知:①该装置的电极材料分别为金属钴和不锈钢。
②Co(H2PO2)2溶液在强碱性条件下通过自身催化发生氧化还原反应,实现化学镀钴。
下列说法中正确的是( )
A.膜Ⅱ、膜Ⅲ均为阴离子交换膜
B.M电极反应为Co-2e-+2H2PO2-=Co(H2PO2)2
C.a为电源的负极
D.Co(H2PO2)2溶液化学镀钴过程中反应可能为Co2++H2PO2-+3OH=Co+HPO3-+2H2O
难度: 中等查看答案及解析
-
氨基甲酸铵(H2NCOONH4)是常用的氨化剂之一。某研究小组利用反应原理:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH<0制备氨基甲酸铵,其装置如图所示,已知:H2NCOONH4(s)白色固体,易分解、易水解。则下列观点不正确的是( )
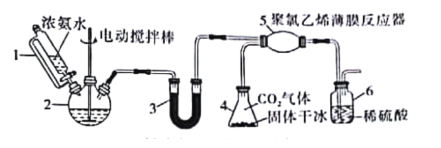
A.仪器1是恒压漏斗,该实验用于防倒吸
B.仪器2和仪器3都可以放置NaOH固体
C.为了完成实验,应在装置5和6之间,依次添加干燥装置和安全瓶
D.若反应初期观察到装置6内稀硫酸溶液中产生气泡,应控制旋塞,加大浓氨水的流速
难度: 中等查看答案及解析
-
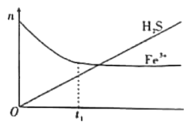
工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=
或
],与pH的变化关系如图所示。则下列说法一定错误的是( )
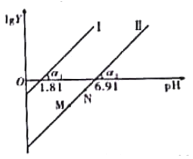
A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.当对应溶液的pH处于1.81<pH<6.91时,溶液中的微粒浓度一定存在c(HSO3-)>c(SO32-)>c(H2SO3)
D.直线Ⅱ中M、N点一定存在c2(HSO3-)>c(SO32-)·c(H2SO3)
难度: 中等查看答案及解析


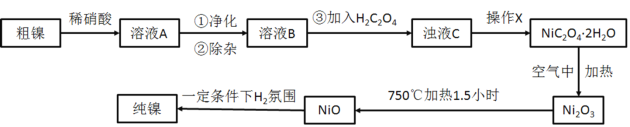
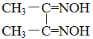 ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。